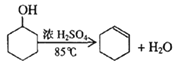
题目内容
【题目】有一种白色粉末是无水碳酸钠和碳酸氢钠的混合物,称取4.42g灼烧至恒重,把放出的气体通入足量澄清石灰水中,生成2.00g沉淀,灼烧后的残渣能与30mL盐酸恰好完全反应.试求:
(1)该白色粉末灼烧后产生气体在标准状况下的体积?
(2)原混合物中各物质的质量.
(3)所用盐酸的物质的量浓度.
【答案】
(1)解:2.00g碳酸钙的物质的量为 ![]() =0.02mol,
=0.02mol,
根据碳元素守恒可知,n(CO2)=n(CaCO3)=0.02mol,
故生成二氧化碳的体积为0.02mol×22.4L/mol=0.448L,
答:该白色粉末灼烧后产生气体在标准状况下的体积为0.448L
(2)解:加热无水碳酸钠和碳酸氢钠的混合物,
发生反应:2NaHCO3 ![]() Na2CO3+CO2↑+H2O,
Na2CO3+CO2↑+H2O,
由方程式可知,n(NaHCO3)=2n(CO2)=0.02mol×2=0.04mol,
故碳酸氢钠的质量为0.04mol×84g/mol=3.36g,
故碳酸钠的质量为4.42g﹣3.36g=1.06g,
答:原混合物中碳酸氢钠的质量为3.36g,碳酸钠的质量为1.06g
(3)解:原混合物中n(NaHCO3)=0.04mol,
n(Na2CO3)= ![]() =0.01mol,
=0.01mol,
灼烧后的残渣为碳酸钠,能与30mL盐酸恰好完全反应生成NaCl,
根据钠离子守恒n(NaCl)=2n(Na2CO3)+n(NaHCO3),
根据氯离子守恒有n(HCl)=n(NaCl),
故n(HCl)=n(NaCl)=2n(Na2CO3)+n(NaHCO3)=0.01mol×2+0.04mol=0.06mol,
故盐酸的物质的量浓度为 ![]() =2mol/L,
=2mol/L,
答:盐酸的物质的量浓度为2mol/L
【解析】(1)加热无水碳酸钠和碳酸氢钠的混合物,发生反应:2NaHCO3 ![]() Na2CO3+CO2↑+H2O,生成的二氧化碳与氢氧化钙溶液反应生成2.00g碳酸钙,根据n=
Na2CO3+CO2↑+H2O,生成的二氧化碳与氢氧化钙溶液反应生成2.00g碳酸钙,根据n= ![]() 计算碳酸钙的物质的量,利用碳元素守恒计算二氧化碳的物质的量,根据V=nVm计算生成的二氧化碳的体积;(2)根据方程式计算原混合物中碳酸氢钠的物质的量,根据m=nM计算碳酸氢钠的质量,进而计算碳酸钠的质量;(3)灼烧后的残渣为碳酸钠,能与30mL盐酸恰好完全反应生成NaCl,根据钠离子守恒n(NaCl)=2n(Na2CO3)+n(NaHCO3),根据氯离子守恒有n(HCl)=n(NaCl),再根据V=
计算碳酸钙的物质的量,利用碳元素守恒计算二氧化碳的物质的量,根据V=nVm计算生成的二氧化碳的体积;(2)根据方程式计算原混合物中碳酸氢钠的物质的量,根据m=nM计算碳酸氢钠的质量,进而计算碳酸钠的质量;(3)灼烧后的残渣为碳酸钠,能与30mL盐酸恰好完全反应生成NaCl,根据钠离子守恒n(NaCl)=2n(Na2CO3)+n(NaHCO3),根据氯离子守恒有n(HCl)=n(NaCl),再根据V= ![]() 计算需要盐酸的体积.
计算需要盐酸的体积.