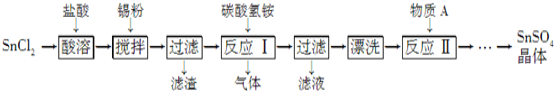
题目内容
【题目】某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示. 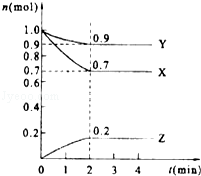
(1)当反应进行到第min,该反应达到平衡.
(2)反应从开始至2分钟末,用X的浓度变化表示的平均反应速率为v(X)=
(3)Y的转化率是
(4)由图中所给数据进行分析,该反应的化学方程为 .
【答案】
(1)2
(2)0.075mol/(L*min)
(3)10%
(4)3X+Y?2Z
【解析】解:(1)根据曲线的变化特点判断达到平衡的时间,达平衡时各物质的量不变,由图可知:2min时,该反应达到平衡,所以答案是:2;(2)根据v= ![]() =
= ![]() =0.075mol/(L*min),所以答案是:0.075mol/(L*min);(3)Y的转化率是
=0.075mol/(L*min),所以答案是:0.075mol/(L*min);(3)Y的转化率是 ![]() =
= ![]() =10%,所以答案是:10%;(4)从曲线的变化趋势可以看出,从反应开始到达到平衡,X、Y的物质的量减少,应为反应物,Z的物质的量增加,应为生成物,从反应开始到第2分钟反应到达平衡状态,X、Y消耗的物质的量分别为0.3 mol、0.1 mol,Z的生成的物质的量为0.2 mol,因此三者比例为3:1:2,物质的量变化之比等于化学计量数之比,则化学方程式为3X+Y2Z,所以答案是:3X+Y2Z.
=10%,所以答案是:10%;(4)从曲线的变化趋势可以看出,从反应开始到达到平衡,X、Y的物质的量减少,应为反应物,Z的物质的量增加,应为生成物,从反应开始到第2分钟反应到达平衡状态,X、Y消耗的物质的量分别为0.3 mol、0.1 mol,Z的生成的物质的量为0.2 mol,因此三者比例为3:1:2,物质的量变化之比等于化学计量数之比,则化学方程式为3X+Y2Z,所以答案是:3X+Y2Z.
【考点精析】本题主要考查了化学平衡的计算的相关知识点,需要掌握反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%才能正确解答此题.

练习册系列答案
相关题目