题目内容
【题目】碱土金属指II A族的铍(Be)、镁(Mg)、钙(Ca)、锶(Sr)、钡(Ba)等元素,它们的单质及其化合物有着广泛的用途。
(1)Be基态原子的轨道表示式为_________________________;
镁和铝的笫二电离能:I2(Mg)_____I2(Al) (填“>”“ <”或“=”)。
(2)在500~600℃气相中,氯化铍以二聚体Be2Cl4, ( )的形式存在,在1000 ℃,氯化铍则以BeCl2形式存在。
)的形式存在,在1000 ℃,氯化铍则以BeCl2形式存在。
①在二聚体Be2Cl4中Be的杂化方式为___________,1mol Be2Cl4中含有_________mol 配位键。
②MgCl2的熔、沸点比BeCl2高的原因是____________________。
(3)根据巴索洛规则:一般来讲,盐中阴、阳离子半径相差较大时,其溶解度较大。则在水中溶解度 S(SrF2)____S(BaF2) (填“>” “<””或“=”)。
(4)石灰氮(CaCN2)—种碱性肥料,可用作除草剂、杀菌剂、杀虫剂等。
①CaCN2中阴离子为CN22-,与CN22-互为等电子体的分子有N2O和________(填化学式),写出CN22-的电子式___________。
②CaCN2与水反应生成CaCO3和NH3两种物质,则1mol CaCN2与水反应的过程中,反应物断裂的σ键总数_______________。
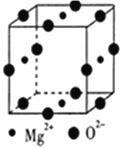
(5) Mg2+与Ni2+、 O2-形成晶体的晶胞结构如图所示(Ni2+未画出),则该晶体的化学式为_________。已知该品胞参数a pm.则该晶体的密度为_________g·cm-3(用a和NA表示)。
【答案】 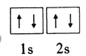 < sp2 2 MgCl2是离子晶体,而BeCl2是分子晶体。发生状态变化时,离子晶体要克服离子键,分子晶体要克服分子间作用力。离子键比分子间作用力强得多。 < CO2
< sp2 2 MgCl2是离子晶体,而BeCl2是分子晶体。发生状态变化时,离子晶体要克服离子键,分子晶体要克服分子间作用力。离子键比分子间作用力强得多。 < CO2 ![]() 4.816×l024 Mg2NiO3
4.816×l024 Mg2NiO3 ![]()
【解析】(1)本题考查轨道式的书写以及第一电离能规律,Be位于第二周期IIA族,因此Be的轨道式为 ;Mg的价电子排布式为3s2,Al的价电子排布式为3s23p1,Mg的价电子能级上电子排满,电子相对稳定,而Al的p能级上没有排满,因此Mg的第一电离能大于Al的第一电离能;(2)考查杂化类型的判断、配位键、熔沸点高低的判断,①Be2Cl4的结构中Be有3个σ键,无孤电子对,因此杂化类型为sp2;Be的最外层有2个电子,只能形成2个化学键,根据结构式,第三个化学键为配位键,因此1mol此物质含有配位键的物质的量为2mol;②根据结构,BeCl2属于分子晶体,而MgCl2属于离子晶体,一般来说离子晶体的熔沸点高于分子晶体,因此有MgCl2熔沸点高于BeCl2;(3)考查半径大小比较,Sr在Ba的上一周期,同主族从上到下原子半径增大,阴离子都是F-,根据信息,BaF2的阴阳离子半径相差比SrF2大,因此SrF2的溶解度小于BaF2;(4)本题考查等电子体的判断、化学键数目的计算,①等电子体:原子总数相同、价电子相同的微粒,因此与CN22-互为等电子体的分子是N2O和CO2;N和C分别形成3、4个键达到稳定,因此CN22-的电子式为:
;Mg的价电子排布式为3s2,Al的价电子排布式为3s23p1,Mg的价电子能级上电子排满,电子相对稳定,而Al的p能级上没有排满,因此Mg的第一电离能大于Al的第一电离能;(2)考查杂化类型的判断、配位键、熔沸点高低的判断,①Be2Cl4的结构中Be有3个σ键,无孤电子对,因此杂化类型为sp2;Be的最外层有2个电子,只能形成2个化学键,根据结构式,第三个化学键为配位键,因此1mol此物质含有配位键的物质的量为2mol;②根据结构,BeCl2属于分子晶体,而MgCl2属于离子晶体,一般来说离子晶体的熔沸点高于分子晶体,因此有MgCl2熔沸点高于BeCl2;(3)考查半径大小比较,Sr在Ba的上一周期,同主族从上到下原子半径增大,阴离子都是F-,根据信息,BaF2的阴阳离子半径相差比SrF2大,因此SrF2的溶解度小于BaF2;(4)本题考查等电子体的判断、化学键数目的计算,①等电子体:原子总数相同、价电子相同的微粒,因此与CN22-互为等电子体的分子是N2O和CO2;N和C分别形成3、4个键达到稳定,因此CN22-的电子式为:![]() ;②发生反应是Ca(CN)2+3H2O=CaCO3+2NH3,1molCa(CN)2中含有σ键物质的量为2mol,1molH2O中σ键物质的量为2mol,因此1molCa(CN)2与水反应断裂的σ键物质的量为(2+3×2)mol=8mol,因此数目为8×6.02×1023=4.816×l024 ;(5)本题考查晶胞的计算,Mg2+位于面心,个数为4×1/2=2,O2-位于棱上,个数为12×1/4=3,根据化合价的代数和为0,则Ni2+个数为1,化学式为Mg2NiO3;晶胞的质量为1×155/NAg,晶胞的体积为(a×10-10)3cm3,根据密度的定义,密度等于.
;②发生反应是Ca(CN)2+3H2O=CaCO3+2NH3,1molCa(CN)2中含有σ键物质的量为2mol,1molH2O中σ键物质的量为2mol,因此1molCa(CN)2与水反应断裂的σ键物质的量为(2+3×2)mol=8mol,因此数目为8×6.02×1023=4.816×l024 ;(5)本题考查晶胞的计算,Mg2+位于面心,个数为4×1/2=2,O2-位于棱上,个数为12×1/4=3,根据化合价的代数和为0,则Ni2+个数为1,化学式为Mg2NiO3;晶胞的质量为1×155/NAg,晶胞的体积为(a×10-10)3cm3,根据密度的定义,密度等于. ![]() g/cm3。
g/cm3。

 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案





