题目内容
食盐是日常生活的必需品,也是重要的化工原料.
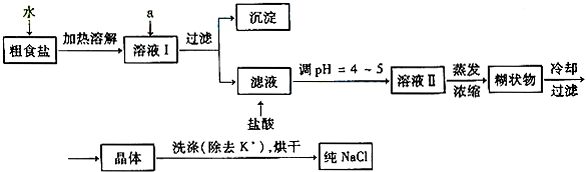
(1)粗食盐常含有少量Ca2+、Mg2+、SO42-等杂质离子,实验室提纯NaCl的流程如下:

提供的试剂如下:饱和Na2CO3溶液 饱和K2CO3溶液 NaOH溶液
BaCl2溶液 Ba(NO3)2溶液
欲除去溶液Ⅰ中的Ca2+、Mg2+、SO42-离子,选出a所代表的多种试剂,按滴加顺序依次为
(2)电解饱和食盐水的装置如图所示,如果在饱和食盐水中滴加酚酞,通电后

(3)实验室制备H2和Cl2通常采用下列反应:
Zn+H2SO4═ZnSO4+H2↑
MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
据此,从下列所给仪器装置中选择制备并收集H2的装置

(1)粗食盐常含有少量Ca2+、Mg2+、SO42-等杂质离子,实验室提纯NaCl的流程如下:

提供的试剂如下:饱和Na2CO3溶液 饱和K2CO3溶液 NaOH溶液
BaCl2溶液 Ba(NO3)2溶液
欲除去溶液Ⅰ中的Ca2+、Mg2+、SO42-离子,选出a所代表的多种试剂,按滴加顺序依次为
NaOH,BaCl2,Na2CO3或(BaCl2,NaOH,Na2CO3)
NaOH,BaCl2,Na2CO3或(BaCl2,NaOH,Na2CO3)
.(只填化学式)(2)电解饱和食盐水的装置如图所示,如果在饱和食盐水中滴加酚酞,通电后
X
X
(填X或Y)极附近溶液变红,写出电解饱和食盐水的化学方程式2NaCl+2H2O
2NaOH+H2↑+Cl2↑
| ||
2NaCl+2H2O
2NaOH+H2↑+Cl2↑
.
| ||

(3)实验室制备H2和Cl2通常采用下列反应:
Zn+H2SO4═ZnSO4+H2↑
MnO2+4HCl(浓)
| ||
据此,从下列所给仪器装置中选择制备并收集H2的装置
e
e
(填代号)和制备并收集干燥、纯净Cl2的装置d
d
(填代号)
分析:(1)把杂质转化为沉淀或气体除去,除钙离子用碳酸根,除镁离子用氢氧根,除硫酸根用钡离子.要注意除杂质的顺序,后加的试剂最好能把前面先加是过量试剂除掉;
(2)根据电解的原理来回答;
(3)根据制取气体的药品和条件来选择仪器和装置.
(2)根据电解的原理来回答;
(3)根据制取气体的药品和条件来选择仪器和装置.
解答:解:(1)除去粗盐中的可溶性杂质:Mg2+、Ca2+、SO42-时,可以加入过量NaOH(去除镁离子和铁离子):Mg2++2OH-=Mg(OH)2↓,Fe3++3OH-═Fe(OH)3↓;加入过量BaCl2(去除硫酸根离子):SO42-+Ba2+=BaSO4↓;加入过量Na2CO3(去除钙离子的多余的钡离子):Ca2++CO32-=CaCO3,碳酸钠必须加在氯化钡之后,,氢氧化钠和氯化钡可以颠倒加入的顺序,
故答案为:BaCl2,NaOH,Na2CO3(或NaOH,BaCl2,Na2CO3);
(2)电解氯化钠时,在阳极是氯离子放电,在阴极是氢离子放电,所以如果在饱和食盐水中滴加酚酞,和电源的负极相连的是阴极区,附近溶液变红,电解原理是:2NaCl+2H2O
2NaOH+H2↑+Cl2↑,
故答案为:X;2NaCl+2H2O
2NaOH+H2↑+Cl2↑;
(3)实验室制氢气:S+l
气体,所以选e,制氯气:S+l
气体,干燥氯气用浓硫酸,出氯化氢用饱和食盐水,故选d,故答案为:e,d.
故答案为:BaCl2,NaOH,Na2CO3(或NaOH,BaCl2,Na2CO3);
(2)电解氯化钠时,在阳极是氯离子放电,在阴极是氢离子放电,所以如果在饱和食盐水中滴加酚酞,和电源的负极相连的是阴极区,附近溶液变红,电解原理是:2NaCl+2H2O
| ||
故答案为:X;2NaCl+2H2O
| ||
(3)实验室制氢气:S+l
| 不加热 |
| △ |
点评:本题考查学生出演的提纯和气体的制备以及收集知识,可以根据所学知识进行回答,难度不大.

练习册系列答案
 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案
相关题目