题目内容
有10.2克镁和铝的混和粉末溶于4摩尔/升的盐酸500毫升中.若加入2摩尔/升的氢氧化钠溶液,要使产生的沉淀的质量最大,则需加入的氢氧化钠溶液的体积为( )A.100毫升
B.500毫升
C.1000毫升
D.1500毫升
【答案】分析:加入2摩尔/升的氢氧化钠溶液,要使产生的沉淀的质量最大,则沉淀为氢氧化镁与氢氧化铝,此时溶液为氯化钠溶液,根据钠离子与氯离子守恒计算氢氧化钠的物质的量,进而计算所需体积.
解答:解:要使产生的沉淀的质量最大,则沉淀为氢氧化镁与氢氧化铝,此时溶液为氯化钠溶液,根据钠离子与氯离子守恒可知:n(NaOH)=n(NaCl)=n(HCl)=0.5L×4mol/L=2mol.
所以需氢氧化钠溶液的体积为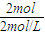 =1L.
=1L.
故选:C.
点评:本题考查学生利用金属与酸反应,盐与碱的反应进行计算,明确酸碱恰好中和时沉淀质量最大及氢氧化铝能溶于强碱时解答本题的关键.
解答:解:要使产生的沉淀的质量最大,则沉淀为氢氧化镁与氢氧化铝,此时溶液为氯化钠溶液,根据钠离子与氯离子守恒可知:n(NaOH)=n(NaCl)=n(HCl)=0.5L×4mol/L=2mol.
所以需氢氧化钠溶液的体积为
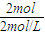 =1L.
=1L.故选:C.
点评:本题考查学生利用金属与酸反应,盐与碱的反应进行计算,明确酸碱恰好中和时沉淀质量最大及氢氧化铝能溶于强碱时解答本题的关键.

练习册系列答案
相关题目
