题目内容
(8分)甲、乙、丙、丁四种物质均为下列离子组成的可溶性化合物,组成这四种物质的离子(离子不能重复组合)有:
现进行以下实验:
①将乙的溶液分别加到足量甲、丁两溶液中时均产生稳定的白色沉淀;
②将少量丙溶液滴入丁溶液时产生白色沉淀,当丙过量时沉淀完全溶解;
③甲、丙两溶液混合时产生的白色沉淀,经分析其中含有两种成份。
据此回答下列问题:
(1)写出电解质的化学式:甲 乙
(2)丙物质中的化学键有 ,丁的阳离子的结构示意图是 ;
(3)写出相应离子方程式:
①甲溶液与丙溶液混合:
②乙溶液与丁溶液混合:
| 阳离子 | Ag+、Mg2+、Al3+、Ba2+ |
| 阴离子 | Cl-、SO 、NO3-、OH- 、NO3-、OH- |
①将乙的溶液分别加到足量甲、丁两溶液中时均产生稳定的白色沉淀;
②将少量丙溶液滴入丁溶液时产生白色沉淀,当丙过量时沉淀完全溶解;
③甲、丙两溶液混合时产生的白色沉淀,经分析其中含有两种成份。
据此回答下列问题:
(1)写出电解质的化学式:甲 乙
(2)丙物质中的化学键有 ,丁的阳离子的结构示意图是 ;
(3)写出相应离子方程式:
①甲溶液与丙溶液混合:
②乙溶液与丁溶液混合:
(8分)(1)化学式:甲 MgSO4 乙 AgNO3 (2分)
(2)离子键 极性共价键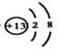 (2分)
(2分)
(3)① Mg2++ SO42-+ Ba2++ 2OH-=== Mg(OH)2↓+BaSO4↓ (2分)
② Ag++Cl-=== AgCl↓ (2分)
(2)离子键 极性共价键
 (2分)
(2分)(3)① Mg2++ SO42-+ Ba2++ 2OH-=== Mg(OH)2↓+BaSO4↓ (2分)
② Ag++Cl-=== AgCl↓ (2分)
(1)根据离子的共存可知,Ag+只能和NO3-共存,所以一定有硝酸银,则另外一种物质就是氢氧化钡。根据实验②可知,丙是氢氧化钡,丁中含有铝离子。根据实验③可知,甲应该是硫酸镁,和氢氧化钡反应生成的白色沉淀是氢氧化镁和硫酸钡,因此丁是氯化铝,乙是硝酸银。
(2)氢氧化钡是离子化合物,含有离子键,同时还含有极性键;铝离子的的核外电子数是10,所以结构示意图是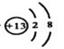 。
。
(3)①甲溶液与丙溶液混合反应的方程式是Mg2++ SO42-+ Ba2++ 2OH-=== Mg(OH)2↓+BaSO4↓ 。
②乙溶液与丁溶液混合反应的方程式是Ag++Cl-=== AgCl↓。
(2)氢氧化钡是离子化合物,含有离子键,同时还含有极性键;铝离子的的核外电子数是10,所以结构示意图是
 。
。(3)①甲溶液与丙溶液混合反应的方程式是Mg2++ SO42-+ Ba2++ 2OH-=== Mg(OH)2↓+BaSO4↓ 。
②乙溶液与丁溶液混合反应的方程式是Ag++Cl-=== AgCl↓。

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案
相关题目