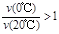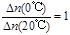题目内容
(12分)在2 L密闭容器中加入1 mol N2和3 mol H2,发生反应:N2+3H2 2NH3
2NH3
(1)该反应是否属于氮的固定? (填“是”或“否”)
(2)充分反应后, (填“能”或“不能”)得到2 mol NH3?为什么?
(3)下列能判断反应达到平衡状态的是
(4)若经5s后,剩下的N2为0. 5 mol,则用H2浓度变化来表示的反应速率是多少?
5s末NH3浓度是多少?
 2NH3
2NH3(1)该反应是否属于氮的固定? (填“是”或“否”)
(2)充分反应后, (填“能”或“不能”)得到2 mol NH3?为什么?
(3)下列能判断反应达到平衡状态的是
| A.N2、H2、NH3的浓度不再发生变化 | B.N2、H2、NH3的分子数相等 |
| C.单位时间内生成a mol N2,同时生成3a mol H2 | D.容器中的压强不再发生变化 |
5s末NH3浓度是多少?
(1)是; (2)不能;因为该反应是可逆反应,反应物不能完全转化为生成物
(3)AD (4)0. 15 mol·L-1·s-1;0. 5 mol·L-1
(3)AD (4)0. 15 mol·L-1·s-1;0. 5 mol·L-1
(1)游离态的氮直接转化为化合态的氮的过程是氮氮固定,所以该反应属于氮的固定。
(2)由于这是1个可逆反应,所以1 mol N2和3 mol H2发生反应,不可能生成2mol氨气。
(3)在一定条件下,当可逆反应中正反应速率和逆反应速率相等时(但不为0),各种物质的浓度或含量均不再发生变化的状态,是化学平衡状态。所以A正确。平衡时浓度不再发生变化,但物质之间的浓度不一定相等或满足某种关系,因此B不正确。选项C中反应速率的方向是相同的,所以不能说明。由于反应前后体积是变化的,所以压强也是变化的。因此当压强不再发生变化时,可以说明反应达到了平衡状态。
(4) N2+3H2 2NH3
2NH3
起始量(mol) 1 3 0
转化量(mol) 0.5 1.5 1.0
平衡量(mol0 0.5 1.5 1.0
所以用H2浓度变化来表示的反应速率是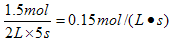
此时氨气的浓度是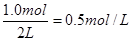
(2)由于这是1个可逆反应,所以1 mol N2和3 mol H2发生反应,不可能生成2mol氨气。
(3)在一定条件下,当可逆反应中正反应速率和逆反应速率相等时(但不为0),各种物质的浓度或含量均不再发生变化的状态,是化学平衡状态。所以A正确。平衡时浓度不再发生变化,但物质之间的浓度不一定相等或满足某种关系,因此B不正确。选项C中反应速率的方向是相同的,所以不能说明。由于反应前后体积是变化的,所以压强也是变化的。因此当压强不再发生变化时,可以说明反应达到了平衡状态。
(4) N2+3H2
 2NH3
2NH3起始量(mol) 1 3 0
转化量(mol) 0.5 1.5 1.0
平衡量(mol0 0.5 1.5 1.0
所以用H2浓度变化来表示的反应速率是
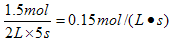
此时氨气的浓度是
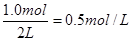

练习册系列答案
相关题目
 2NO2(气)+热量,不能说明已达到平衡状态的是( )
2NO2(气)+热量,不能说明已达到平衡状态的是( )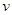 正(NO2) =
正(NO2) = CH3OH(g) ΔH=-90.7 kJ/mol):
CH3OH(g) ΔH=-90.7 kJ/mol): 3C(g),达到平衡后生成1.5 mol C,此时,平衡混合气中C的体积分数为ω;若将温度升高到70℃后,其他条件均不变,当反应重新达到平衡时,C的物质的量为1.2 mol。
3C(g),达到平衡后生成1.5 mol C,此时,平衡混合气中C的体积分数为ω;若将温度升高到70℃后,其他条件均不变,当反应重新达到平衡时,C的物质的量为1.2 mol。 cC(s)+dD(g)达到平衡时,其反应的K值与温度有关。请写出该反应的平衡常数表达式
cC(s)+dD(g)达到平衡时,其反应的K值与温度有关。请写出该反应的平衡常数表达式  ,利用此概念可以讨论许多化学问题:
,利用此概念可以讨论许多化学问题: 4NO(g)+6H2O(g);假如温度保持不变并充入He,则平衡 (填“正向移动”、“逆向移动”、“不移动”),
4NO(g)+6H2O(g);假如温度保持不变并充入He,则平衡 (填“正向移动”、“逆向移动”、“不移动”), (混合气)将 (填写“变大”、“变小”或“不变”);
(混合气)将 (填写“变大”、“变小”或“不变”); C(g)+D(g)已达平衡的是
C(g)+D(g)已达平衡的是  2C(g)+D(g),下列物理量不能确定达到平衡状态的是
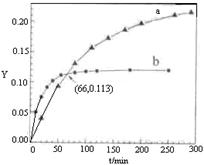
2C(g)+D(g),下列物理量不能确定达到平衡状态的是 CH3COCH2COH(CH3)2(l)。取等量CH3COCH3,分别在0℃和20℃下,测得其转化分数随时间变化的关系曲线(Y-t)如右图所示。下列说法正确的是( )
CH3COCH2COH(CH3)2(l)。取等量CH3COCH3,分别在0℃和20℃下,测得其转化分数随时间变化的关系曲线(Y-t)如右图所示。下列说法正确的是( )