题目内容
一定量的KMnO4与足量的250mL浓盐酸反应,方程式为2KMnO4 + 16HCl(浓) =" 2KCl" + 5Cl2↑ + 2MnCl2 + 8H2O,反应结束后,共转移电子为5mol,则还原产物中,阳离子的物质的量浓度为(溶液的体积变化忽略不计)
| A.10mol/L | B.2mol/L | C.4mol/L | D.8mol/L |
C
方程式为2KMnO4 + 16HCl(浓) =" 2KCl" + 5Cl2↑ + 2MnCl2 + 8H2O中,氧化剂为KMnO4,反应后生成的MnCl2为还原产物,当有2mol KMnO4完全反应,则共转移电子为10mol,若反应结束后,共转移电子为5mol,则还原产物MnCl2的物质的量为1mol,即可得阳离子的物质的量浓度为4mol/L ;

练习册系列答案
相关题目
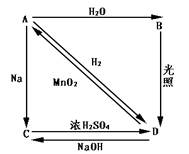
 :
: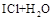 =HCl+HIO下列叙述正确的是
=HCl+HIO下列叙述正确的是 ______________________________,漂白粉的有效成分是(填化学式)
______________________________,漂白粉的有效成分是(填化学式)  酸钙能发生下列反应:Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O,该反应中转移的电子数为___________
酸钙能发生下列反应:Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O,该反应中转移的电子数为___________