题目内容
(15分)四种主族元素的性质或结构信息如下:
(1)M的原子结构示意图是 ;上述元素最高价氧化物对应的水化物碱性最强的是(写分子式) (元素用元素符号表示,下同!)。
(2)Y单质溶于热浓的硫酸产生的气体的化学式为 。
(3)能体现Z单质比Y单质活泼性强的一个化学方程式: 。
(4)常温下,不能与X的单质持续发生反应的是(填选项序号) 。
A.CuSO4溶液 B.Fe2O3 C.浓硫酸 D.NaOH溶液 E.Na2CO3固体
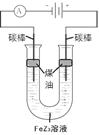
(5)铁元素与Z元素形成化合物FeZ3,FeZ3溶液按下图所示进行试验。装置通电后,连接电源 (填“正极”或“负极”)碳棒边的煤油颜色将变深,另一碳棒附近溶液将出现的现象是 。
| 元素编号 | 相关信息 |
| X | 地壳中含量最大的金属元素;元素最高价为+3价。 |
| Y | 原子最外层电子数是电子层数的2倍,最外层电子数是X最外层电子数的2倍。 |
| Z | 同周期主族元素中原子半径最小,常温下单质呈液态。 |
| M | 能从海水中提取的金属元素,单质可在氮气或二氧化碳中燃烧。 |
(2)Y单质溶于热浓的硫酸产生的气体的化学式为 。
(3)能体现Z单质比Y单质活泼性强的一个化学方程式: 。
(4)常温下,不能与X的单质持续发生反应的是(填选项序号) 。
A.CuSO4溶液 B.Fe2O3 C.浓硫酸 D.NaOH溶液 E.Na2CO3固体
(5)铁元素与Z元素形成化合物FeZ3,FeZ3溶液按下图所示进行试验。装置通电后,连接电源 (填“正极”或“负极”)碳棒边的煤油颜色将变深,另一碳棒附近溶液将出现的现象是 。

(1)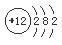 ; Mg(OH)2;(2)SO2(3)S2- + Br2 =" S" + 2Br-
; Mg(OH)2;(2)SO2(3)S2- + Br2 =" S" + 2Br-
4)B C E (5)正极 溶液逐渐变成浅绿色。
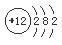 ; Mg(OH)2;(2)SO2(3)S2- + Br2 =" S" + 2Br-
; Mg(OH)2;(2)SO2(3)S2- + Br2 =" S" + 2Br-4)B C E (5)正极 溶液逐渐变成浅绿色。
试题分析:根据题意可知:X是Al;Y是S;Z是Br;M是Mg。(1)Mg的原子结构示意图是
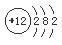 ;在上述元素中金属性最强的元素是Mg,其最高价氧化物对应的水化物碱性最强,化学式是Mg(OH)2;(2)(2)S单质溶于热浓的硫酸发生反应: S+2H2SO4(浓)△3SO2↑+2H2O产生的气体的化学式为SO2,(3)活动性强的能把活动性弱的从化合物中置换出来。能体现Z单质比Y单质活泼性强的一个化学方程式:Na2S+ Br2 =" S↓+" 2NaBr;离子方程式是S2- + Br2 =" S" ↓+ 2Br-。(4)A.Al+ 3CuSO4= 3Cu+Al2(SO4)3.错误。B.Fe2O3与Al发生反应要在高温条件下,在常温不能反应。正确。C.在常温下Al遇浓硫酸会发生钝化,使反应不能在进行。正确。D.2Al+2NaOH+2H2O=2NaAlO2+3H2↑.错误。E.Na2CO3固体与Al不能发生反应。正确。因此选项为B C E。(5)用惰性电极电解FeBr3溶液。由于阴离子的放电能力Br->OH-,所以在与电源的正极相连接的阳极碳棒上发生反应:2Br--2e-=Br2. Br2容易溶解在煤油中,所以煤油颜色将变深,在阴极碳棒上发生反应:2Fe3++2e-=2Fe2+;附近的水溶液由黄色溶液逐渐变成浅绿色。
;在上述元素中金属性最强的元素是Mg,其最高价氧化物对应的水化物碱性最强,化学式是Mg(OH)2;(2)(2)S单质溶于热浓的硫酸发生反应: S+2H2SO4(浓)△3SO2↑+2H2O产生的气体的化学式为SO2,(3)活动性强的能把活动性弱的从化合物中置换出来。能体现Z单质比Y单质活泼性强的一个化学方程式:Na2S+ Br2 =" S↓+" 2NaBr;离子方程式是S2- + Br2 =" S" ↓+ 2Br-。(4)A.Al+ 3CuSO4= 3Cu+Al2(SO4)3.错误。B.Fe2O3与Al发生反应要在高温条件下,在常温不能反应。正确。C.在常温下Al遇浓硫酸会发生钝化,使反应不能在进行。正确。D.2Al+2NaOH+2H2O=2NaAlO2+3H2↑.错误。E.Na2CO3固体与Al不能发生反应。正确。因此选项为B C E。(5)用惰性电极电解FeBr3溶液。由于阴离子的放电能力Br->OH-,所以在与电源的正极相连接的阳极碳棒上发生反应:2Br--2e-=Br2. Br2容易溶解在煤油中,所以煤油颜色将变深,在阴极碳棒上发生反应:2Fe3++2e-=2Fe2+;附近的水溶液由黄色溶液逐渐变成浅绿色。
练习册系列答案
相关题目