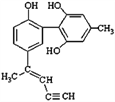
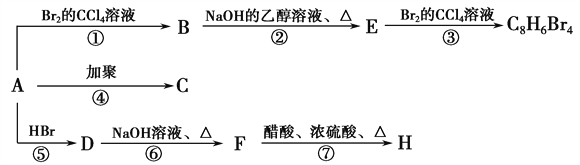
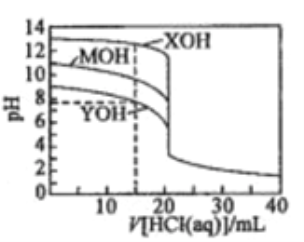
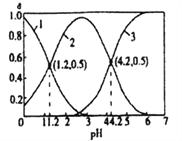
题目内容
【题目】下列各组化合物中,只含有离子键的是( )
A.NaOH和NaHSB.CaCl2和Na2O
C.CO2和K2SD.H2O2和HCl
【答案】B
【解析】
A.NaOH中Na+和OH-形成离子键,OH-中O原子和H原子形成共价键,NaHS中既含有离子键,也含有共价键,A不符合题意;
B.CaCl2和Na2O中均只含有离子键,B符合题意;
C.CO2分子中只含有共价键,K2S只含有离子键,C不符合题意;
D.H2O2、HCl分子中均只含有共价键,D不符合题意;
答案选B。

练习册系列答案
相关题目
【题目】下表是常温下,浓度为0.01mol/L的NaOH溶液与几种酸或盐混合后的情况:
混合组别 | 混合前酸或盐的总浓度 | 混合比例及混合溶液性质 |
① | c(HA)=0.02mol/L | 等体积混合,pH>7 |
② | HB溶液的pH=2 | V1mLNaOH溶液与V2mLHB溶液,pH=7 |
③ | c(H2C)=0.01mol/L | 等体积混合,pH>7 |
④ | c(NaHD)=0.01mol/L | 等体积混合,pH=7 |
回答下列问题:
(1)①组混合液中,HA、A-、Na+三种粒子浓度由大到小的顺序为________,若pH=8,则c(Na+)-c(A-)=________mol/L(填具体数字)。
(2)由②组混合液pH=7可推知,V1____V2。
(3)③组混合液中,pH>7的原因是______________________。
(4)0.01mol/LNaHD溶液中,水的电离度=_________。(已知:水的电离度=[已电离的水分子的个数/水分子总数]×100%)
(5)仅凭上述结果,一定能确定HA、HB、H2C、H2D四种酸中属于弱酸的是_________。