题目内容
在下列各溶液中,离子一定能大量共存的是 ( )
A.强碱性溶液中:K+、Al3+、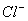 、
、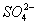
B.含有0.1 mol·L-1 Fe3+的溶液中:K+、Mg2+、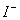 、
、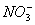
C.含有0.1 mol·L-1Ca2+溶液在中:Na+、K+、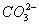 、
、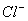
D.室温下,pH=1的溶液中: Na+、Fe3+、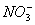 、
、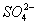
【答案】D
【解析】A项,强碱性溶液意味着存在大量的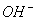 ,所以Al3+不能共存(Al3++3
,所以Al3+不能共存(Al3++3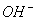 =Al(OH)3↓);B项,Fe3+和I-因发生氧化还原反应而不能共存(2Fe3++2I-=2Fe2++I2);C项,Ca2+和
=Al(OH)3↓);B项,Fe3+和I-因发生氧化还原反应而不能共存(2Fe3++2I-=2Fe2++I2);C项,Ca2+和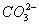 因发生复分解反应而不能共存
因发生复分解反应而不能共存
【考点分析】离子共存问题(一色、二性、三特殊、四反应牢记)
①由于发生复分解反应,离子不能大量共存;
②由于发生氧化还原反应,离子不能大量共存;
③溶液酸碱性的判断(隐含条件)。

练习册系列答案
相关题目


 与
与 反应生成CO2(g)和
反应生成CO2(g)和 的热化学方程式为 。
的热化学方程式为 。 (3)
(3) 是一种储氢合金。350℃时,
是一种储氢合金。350℃时, 反
反  Ⅱ、碘钨灯具有使用寿命长、节能环保等优点。一定温度下,在碘钨灯灯泡内封存的少量碘与沉积在灯泡壁上的钨可以发生可逆反应:
Ⅱ、碘钨灯具有使用寿命长、节能环保等优点。一定温度下,在碘钨灯灯泡内封存的少量碘与沉积在灯泡壁上的钨可以发生可逆反应: 。为模拟该反应,在实验室中准确称取0.508 g碘、0.6992 g金属钨放置于50.0 mL密闭容器中,在一定温度下反应。如图是混合气体中的
。为模拟该反应,在实验室中准确称取0.508 g碘、0.6992 g金属钨放置于50.0 mL密闭容器中,在一定温度下反应。如图是混合气体中的 蒸气的物质的量随时间变化关系的图象
蒸气的物质的量随时间变化关系的图象 ,其中曲线I(0~t2时间段)的反应温度为450 ℃,曲线Ⅱ(从t2时刻开始)的反应温度为530℃。
,其中曲线I(0~t2时间段)的反应温度为450 ℃,曲线Ⅱ(从t2时刻开始)的反应温度为530℃。

 mol3
mol3 mol3.L-3).
mol3.L-3).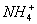 )>c(
)>c(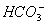 )>c(H+)
)>c(H+)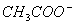 )+c(
)+c(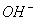 )的操作是 ( )
)的操作是 ( )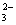 和OH-
和OH-