题目内容
0.3mol气态高能燃料乙硼烷(分子式B2H6),在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5kJ的热量,则其热化学方程式为________________。又已知H2O(l)=H2O(g);△H=44kJ?mol-1,则11.2L标准状况下的乙硼烷完全燃烧生成气态水时放出的热量是_________kJ。
解析:
1molB2H6(g)完全燃烧,生成液态水放出的热量为649.5kJ÷0.3=2165kJ。因此热化学方程式为:B2H6(g)+3O2=B2H3(s)+3H2O(l);△H=-2165kJ?mol-1。若反应生成的3mol H2O(l)全部转化为气态水,则需吸收热量44kJ?mol-1×3mol=132kJ,则0.5mol B2H6(g)完全燃烧生成气态水时放出的热量为: ![]()
答案:
B2H6(g)+3O2(g)=B2H3(s)+3H2O(l);△H=-2165kJmol-1 ;1016.5

练习册系列答案
相关题目
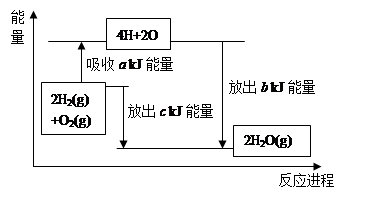
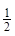 O2(g)=H2O(l) ΔH3= ─285.8 kJ?mol-1
O2(g)=H2O(l) ΔH3= ─285.8 kJ?mol-1