题目内容
已知0.3mol气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放
出649.5KJ的热量。
(1)写出反应的热化学方程式
(2)已知H2O(l)转化为H2O(g)的△H=44KJ/mol,计算11.2L(标准状况)气态乙硼烷完全燃烧生成气态水时放出的热量为 。
【答案】
B2H6(g)+3O2(g)=B2O3(s)+3H2O(l) H=-2165KJ/mol 1016.5KJ
【解析】
试题分析:(1)0.3mol气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5KJ的热量,则1mol乙硼烷完全燃烧放出的热量是649.5KJ÷0.3=2165kJ,则该反应的热化学方程式是B2H6(g)+3O2(g)=B2O3(s)+3H2O(l) H=-2165KJ/mol。
(2)H2O(l)转化为H2O(g)的△H=44KJ/mol,则该反应如果生成气态水的热化学方程式应该是B2H6(g)+3O2(g)=B2O3(s)+3H2O(l) H=-2033KJ/mol。11.2L(标准状况)气态乙硼的物质的量是0.5mol,则放出的热量是2033KJ/mol×0.5mol=1016.5kJ。
考点:考查热化学方程式的书写和反应热的判断
点评:该题是高考中的常见题型,属于基础性试题的考查,难度不大。该题的关键是明确热化学方程式的含义以及书写的注意事项,然后结合题意灵活运用即可,有利于培养学生的规范答题能力。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
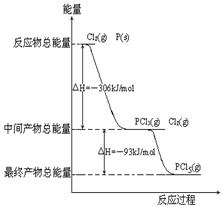
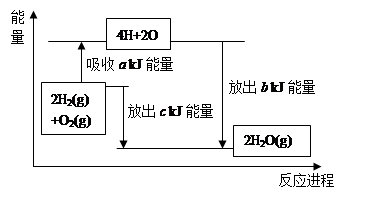
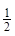 O2(g)=H2O(l) ΔH3= ─285.8 kJ?mol-1
O2(g)=H2O(l) ΔH3= ─285.8 kJ?mol-1