题目内容
已知:A、B、C、D、E、F是周期表中前36号元素,A是原子半径最小的元素,B元素基态原子的2p轨道上只有两个电子,C元素的基态原子L层只有2对成对电子,D是元素周期表中电负性最大的元素,E2+的核外电子排布和Ar原子相同,F的核电荷数是D和E的核电荷数之和。
请回答下列问题:
(1)分子式为BC2的空间构型为 形;F2+的核外电子排布式为 。
(2)A分别与B、C形成的最简单化合物的稳定性B C(填“大于”或“小于”);A、C两元素可组成原子个数比为1∶1 的化合物,C元素的杂化类型为 。
(3)A2C所形成的晶体类型为 ;F单质形成的晶体类型为 。
(4)F元素氧化物的熔点比其硫化物的 (填“高”或“低”),请解释其原因
。
(5)E元素与C元素形成的化合物是 化合物,其晶体熔化时破坏的作用力是 ,晶体EC的熔点比晶体BC2的熔点 (填“高”或“低”)。
请回答下列问题:
(1)分子式为BC2的空间构型为 形;F2+的核外电子排布式为 。
(2)A分别与B、C形成的最简单化合物的稳定性B C(填“大于”或“小于”);A、C两元素可组成原子个数比为1∶1 的化合物,C元素的杂化类型为 。
(3)A2C所形成的晶体类型为 ;F单质形成的晶体类型为 。
(4)F元素氧化物的熔点比其硫化物的 (填“高”或“低”),请解释其原因
。
(5)E元素与C元素形成的化合物是 化合物,其晶体熔化时破坏的作用力是 ,晶体EC的熔点比晶体BC2的熔点 (填“高”或“低”)。
(1)直线 1s22s22p63s23p63d9或[Ar]3d9
(2)小于 sp3
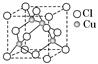
(3)分子晶体 金属晶体
(4)高 CuO的晶格能大于CuS的晶格能
(5)离子 离子键 高
(2)小于 sp3
(3)分子晶体 金属晶体
(4)高 CuO的晶格能大于CuS的晶格能
(5)离子 离子键 高
由题意可以判断出A为H元素,根据电子排布特点可以得出B为C元素,C为O元素。电负性最大的是非金属性最强的F元素,E为Ca元素,F应该是29号元素Cu。(1)CO2的空间构型为直线形,Cu2+电子排布式为1s22s22p63s23p63d9或[Ar]3d9。(2)氧元素非金属性比碳元素强,可知稳定性CH4<H2O,H2O2的O的杂化类型,根据VSEPR模型应该是四面体形,sp3杂化。(3)冰为分子晶体,Cu为金属晶体。(4)离子晶体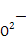 半径小于
半径小于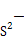 半径,故CuO的离子键强,晶格能较大,熔点较高。(5)CaO是离子化合物,晶体熔化时破坏离子键,CO2形成的晶体为分子晶体,熔点较低。
半径,故CuO的离子键强,晶格能较大,熔点较高。(5)CaO是离子化合物,晶体熔化时破坏离子键,CO2形成的晶体为分子晶体,熔点较低。
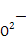 半径小于
半径小于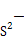 半径,故CuO的离子键强,晶格能较大,熔点较高。(5)CaO是离子化合物,晶体熔化时破坏离子键,CO2形成的晶体为分子晶体,熔点较低。
半径,故CuO的离子键强,晶格能较大,熔点较高。(5)CaO是离子化合物,晶体熔化时破坏离子键,CO2形成的晶体为分子晶体,熔点较低。
练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
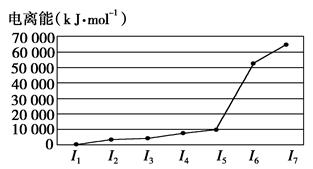

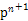 ,该元素原子的核外最外层电子的孤电子对数为 ;该元素与元素①形成的分子X构形为 ;X在①与③形成的分子Y中的溶解度很大,其主要原因是 。
,该元素原子的核外最外层电子的孤电子对数为 ;该元素与元素①形成的分子X构形为 ;X在①与③形成的分子Y中的溶解度很大,其主要原因是 。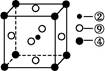

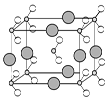
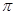 键有 mol。
键有 mol。