题目内容
【题目】如图为元素周期表的一部分,a、b、c…为部分元素.回答下列问题: 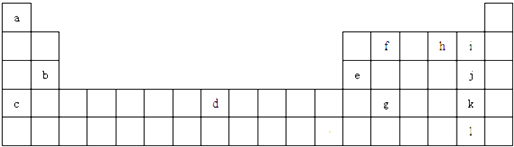
(1)请写出上述元素d的价电子排布式;
(2)请写出j的单质与a、h形成的化合物发生反应的化学方程式;
(3)请比较b、e、j三种元素的第一电离能由大到小的顺序(写元素符号);
(4)请写出e元素最高价氧化物对应的水合物与a、c、h三种元素形成的化合物反应的离子方程式;
(5)j、k、l三种元素之间能以原子个数比1:1两两形成互化物,这些互化物的性质类似于这些元素单质的性质.请写出k、l的互化物的电子式 , 它是由键形成的(根据原子轨道的重叠程度填写).
【答案】
(1)3d54s1
(2)Cl2+H2O=HClO+HCl
(3)Cl>Mg>Al
(4)Al(OH)3+OH﹣=AlO2﹣+2H2O
(5)![]() ;σ
;σ
【解析】解:由图可知,a为H、b为Mg、c为K、d为Fe、e为Al、f为C、h为O,i为F,j为Cl,k为Br,l为I,g为Ge,(1)Fe为第ⅤⅢ族元素,原子序数为26,则d的价电子排布式为3d54s1 , 所以答案是:3d54s1;(2)氯气与水反应生成盐酸和HClO,化学反应方程式为Cl2+H2O=HClO+HCl,所以答案是:Cl2+H2O=HClO+HCl;(3)非金属性越强,第一电离能越大,Mg的3s为全满稳定结构,b、e、j三种元素的第一电离能由大到小的顺序为Cl>Mg>Al,所以答案是:Cl>Mg>Al;(4)氢氧化铝和NaOH反应生成偏铝酸钠和水,反应离子方程式为Al(OH)3+OH﹣=AlO2﹣+2H2O,所以答案是:Al(OH)3+OH﹣=AlO2﹣+2H2O;(5)k、l的互化物为IBr,电子式为 ![]() ,含I﹣br键,为共价单键,属于σ键形成的,所以答案是:
,含I﹣br键,为共价单键,属于σ键形成的,所以答案是: ![]() ;σ.
;σ.

练习册系列答案
相关题目