题目内容
18.下列说法正确的是( )| A. | 0.01mol/L H2S溶液中:c(H+):c(S2-)=2:1 | |
| B. | 加水稀释CH3COOH稀溶液,Ka(CH3COOH)增大 | |
| C. | 加热蒸馏水,蒸馏水的pH减小 | |
| D. | 稀释NH4Cl溶液,NH4+的水解程度减小 |
分析 A.H2S是二元弱酸,水溶液中分步电离;
B.电离平衡常数只随温度变化,不随浓度变化;
C.加热促进水的电离,氢离子浓度增大,PH减小;
D.氯化铵是强酸弱碱盐水解平衡中加水稀释促进水解;
解答 解:A.H2S是二元弱酸,水溶液中分步电离,H2S?HS-+H+,HS-?H++S2-,c(H+):c(S2-)>2:1,故A错误;
B.加水稀释CH3COOH稀溶液,Ka(CH3COOH)不变,故B错误;
C.加热蒸馏水,促进水的电离,氢离子浓度增大,蒸馏水的pH减小,故C正确;
D.稀释NH4Cl溶液,NH4+的水解程度增大,故D错误;
故选C.
点评 本题考查了静置电离平衡的影响因素分析、电离平衡常数和弱电解质电离平衡是解题关键,题目难度中等.

练习册系列答案
相关题目
13.两种气态烃的混合物共2.24L(标准状况),完全燃烧后得3.36L(标准状况)二氧化碳和3.6g的水.下列说法中正确的是( )
| A. | 混合气体中一定含有甲烷 | B. | 混合气体中一定含有乙烯 | ||
| C. | 混合气体中可能含有乙炔 | D. | 混合气体一定是由烷烃和烯烃构成 |
3.下列实验中,对应的现象以及结论都正确且两者具有因果关系的是( )
| 选项 | 实验 | 现象 | 结论 |
| A | 用pH试纸检测:0.1mol•L-1Na2SO3溶液、0.1mol•L-1NaHSO3溶液 | Na2SO3溶液的pH 约为10;NaHSO3 溶液的pH约为5 | HSO3-结合H+的能力比SO32-强 |
| B | 向含有酚酞的Na2CO3溶液中加入少量BaCl2固体 | 溶液红色变浅 | Na2CO3溶液中存在水解平衡 |
| C | 注射器中吸入NO2,封堵针尖处,将注射器体积压缩为原来的一半 | 气体颜色比起始时浅 | 加压后,NO2转变为无色的N2O4 |
| D | 饱和BaSO4悬浊液中加入饱和Na2CO3溶液,振荡,然后过滤、洗涤,向所得固体中加入盐酸 | 沉淀部分溶解且有 气体产生 | Ksp(BaSO4)> Ksp(BaCO3) |
| A. | A | B. | B | C. | C | D. | D |
10.下列实验操作能达到实验目的是( )
| 实验操作 | 实验目的 | |
| A | 将SO2通入紫色石蕊溶液中 | 证明SO2具有漂白性 |
| B | 取两支试管,分别加入4mL0.01mol•L-1KMnO4溶液,然后向一支试管中加0.1mol•L-1H2C2O4溶液2mL,向另一支试管中加入0.1mol•L-1H2C2O4溶液4mL,记录褪色时间 | 证明草酸浓度越大,反应速率越快 |
| C | 向10mL0.2mol•L-1NaOH溶液中滴入2滴入两滴0.1mol•L-1MgCl2溶液,产生白色沉淀后,再滴加2滴0.1mol•L-1FeCl2溶液,又生成红褐色沉淀 | 证明在相同温度下的溶度积:Ksp[Mg(OH)2]>Ksp[Fe(OH)3] |
| D | 向含酚酞的Na2SO4溶液中加入BaCl2溶液 | 证明Na2SO4溶液中存在水解平衡 |
| A. | A | B. | B | C. | C | D. | D |
16.如图所示与对应叙述相符的是( )
| A. |  图表示一定温度下FeS和CuS的沉淀溶解平衡曲线,则Ksp(FeS)<Ksp(CuS) | |
| B. |  图表示pH=2的甲酸与乙酸溶液稀释时的pH变化曲线,则酸性:甲酸<乙酸 | |
| C. |  图表示用0.l0 mol•L-1NaOH溶液滴定25.00 mL盐酸的滴定曲线,则c(HCl)=0.08mol•L-1 | |
| D. |  图表示反应N2(g)+3H2(g)?2NH3(g)平衡时NH3体积分数随起始$\frac{n({N}_{2})}{n({H}_{2})}$,变化的曲线,则转化率:αA(H2)=αB(H2) |
17.两种气态烷烃的混合物在标准状况下的密度是1.34g/L,则关于此混合物组成的说法正确的是( )
| A. | 可能是甲烷和丙烷的混合物 | B. | 一定有甲烷 | ||
| C. | 可能是乙烷和丙烷的混合物 | D. | 一定有乙烷 |




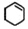 )为原料合成,路线如下(部分反应条件省略):
)为原料合成,路线如下(部分反应条件省略):



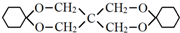 .
. .
.