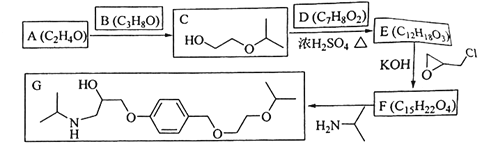
题目内容
【题目】(1)相同质量的氢气、甲烷(CH4)、水,其中含分子数最多的是________;等物质的量的三种物质含氢原子最多的是________。
(2)某气体氧化物的化学式为RO2,在标准状况下,0.92 g该氧化物的体积为448 mL,则该氧化物的物质的量为______,该氧化物的摩尔质量为______。
(3)某化学兴趣小组对某品牌矿泉水进行检测时,发现1.0 L该矿泉水中含有45.6 mg Mg2+,Mg2+的物质的量浓度为______。
(4)现有0.1 mol·L-1 Na2SO4和0.3 mol·L-1 H2SO4的混合溶液100 mL,向其中逐滴加入0.2 mol·L-1的Ba(OH)2溶液,并不断搅拌,使反应充分进行。(忽略混合过程中的体积变化)
①当加入50 mL Ba(OH)2溶液时,所得溶液中SO42-离子的物质的量浓度为________mol·L-1。
②当溶液中沉淀量达到最大时,所加Ba(OH)2溶液的体积为________mL。
【答案】氢气 氢气 0.02mol 46g/mol 0.0019mol/L 0.2 200
【解析】
(1)根据n=![]() 计算物质的量,再根据n=
计算物质的量,再根据n=![]() 计算分子数目多少;最后结合分子构成判断H原子个数;
计算分子数目多少;最后结合分子构成判断H原子个数;
(2)根据n=![]() 计算气体的物质的量,再根据n=
计算气体的物质的量,再根据n=![]() 计算其摩尔质量;
计算其摩尔质量;
(3)根据n=![]() 、c=
、c=![]() 计算离子的浓度;
计算离子的浓度;
(4)①先计算溶液中SO42-的物质的量,根据SO42-+Ba2+=BaSO4↓,计算加入50 mL Ba(OH)2溶液时消耗的SO42-的物质的量,利用剩余SO42-的物质的量结合c=![]() 计算剩余SO42-的浓度;②当溶液中沉淀量达到最大时,恰好SO42-+Ba2+=BaSO4↓发生完全,n(Ba2+)=n(SO42-),再结合Ba(OH)2溶液的浓度,利用c=
计算剩余SO42-的浓度;②当溶液中沉淀量达到最大时,恰好SO42-+Ba2+=BaSO4↓发生完全,n(Ba2+)=n(SO42-),再结合Ba(OH)2溶液的浓度,利用c=![]() 计算氢氧化钡溶液的体积。
计算氢氧化钡溶液的体积。
(1)设物质的质量都为mg,则H2的物质的量n(H2)=![]() mol,甲烷的物质的量n(CH4)=
mol,甲烷的物质的量n(CH4)=![]() mol,水的物质的量n(H2O)=
mol,水的物质的量n(H2O)=![]() mol,可见,三种物质H2的物质的量最多,根据n=
mol,可见,三种物质H2的物质的量最多,根据n=![]() 可知,物质的量越多,物质内含有的分子数目就越多,故含分子数最多的是氢气;
可知,物质的量越多,物质内含有的分子数目就越多,故含分子数最多的是氢气;
三种物质具有相同质量时,含氢原子的物质的量分别为H2:2×![]() mol=mmol;CH4:4×
mol=mmol;CH4:4×![]() mol=
mol=![]() mol;H2O:2×
mol;H2O:2×![]() mol=
mol=![]() mol,所以含氢原子最多的是氢气;
mol,所以含氢原子最多的是氢气;
(2)n=![]() =0.02mol,根据n=
=0.02mol,根据n=![]() 可知该氧化物的摩尔质量M=
可知该氧化物的摩尔质量M=![]() =46g/mol;
=46g/mol;
(3)n(Mg2+)=![]() =0.0019mol,则根据物质的量浓度定义式可得c=
=0.0019mol,则根据物质的量浓度定义式可得c=![]() =0.0019mol/L;
=0.0019mol/L;
(4)①0.1 mol/L Na2SO4和0.3 mol/L H2SO4的混合溶液100 mL中含有的SO42-的物质的量n(SO42-)=0.1mol/L×0.1L+0.3mol/L×0.1L=0.04mol,当加入50 mL Ba(OH)2溶液时,加入的Ba2+的物质的量n(Ba2+)=0.2mol/L×0.05L=0.01mol,根据SO42-+Ba2+=BaSO4↓可知0.01molBa2+会消耗0.01mol SO42-,剩余反应后溶液中SO42-的物质的量为0.04mol-0.01mol=0.03mol,因此此时溶液中SO42-的浓度c(SO42-)=0.03mol÷0.15L=0.2mol/L;
(2)当溶液中沉淀量达到最大时,SO42-反应完全,根据SO42-+Ba2+=BaSO4↓可知所加Ba(OH)2溶液的物质的量为0.04mol,根据c=![]() 可知此时溶液的体积V[Ba(OH)2]=
可知此时溶液的体积V[Ba(OH)2]= ![]() =0.2L=200mL。
=0.2L=200mL。