题目内容
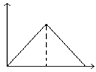
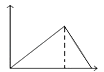
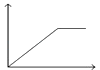
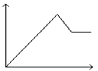
【题目】根据下列装置,回答1-2小题
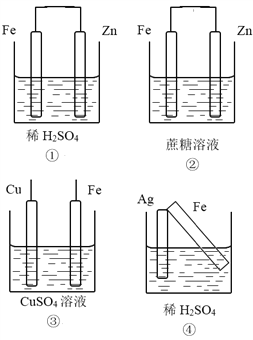
【1】以上四个装置,能够构成原电池的是 ( )
A. ① B. ② C. ①④ D. ②③
【2】对①装置叙述正确的是( )
A. 电子经导线由Fe流向Zn B. Fe处发生氧化反应
C. Fe作正极,Zn作负极 D. Zn处发生还原反应
【答案】
【1】C
【2】C
【解析】根据原电池的构成条件分析,原电池的构成条件是:①有两个活泼性不同的电极,②将电极插入电解质溶液中,③两电极间构成闭合回路,④能自发的进行氧化还原反应。
【1】①该装置符合原电池的构成条件,所以能形成原电池,故①;②蔗糖不是电解质,锌和蔗糖不能自发的进行氧化还原反应,所以不能构成原电池,故②错误;③两电极间不能构成闭合回路,故③错误;④该装置符合原电池的构成条件,所以能形成原电池,故④正确;故选C。
【2】A、电子经导线由Zn流向Fe,故A错误; B、 Fe处氢离子得电子,发生还原反应,Zn处发生氧化反应,Zn失电子,化合价升高,被氧化,故B错误;C、 Zn比Fe活泼,Fe作正极,Zn作负极,故C正确;D、 Zn处发生氧化反应,Zn失电子,化合价升高,被氧化,故D错误;故选C。

练习册系列答案
相关题目