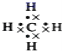题目内容
【题目】下表是元素周期表的一部分, 针对表中的①~⑩种元素,填写下列空白:
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ⑨ | ⑩ |
(1)元素⑩名称为_______在周期表中的位置________________。
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是_______,碱性最强的化合物的电子式是:_____________。
(3)元素④与⑥形成的化合物的电子式为:
(4)写出一种由上述元素组成的既有离子键又有非极性共价键的物质的化学式________。
(5)⑥、⑦、⑨三种元素形成的离子,离子半径由大到小的顺序是___________________(用离子符号表示)。
【答案】溴 第4周期第ⅦA族 HClO4 ![]()
![]() 离子 Na2O2 S2- > Cl- > K+
离子 Na2O2 S2- > Cl- > K+
【解析】
以上元素①为C,②为N,③为O,④为Na,⑤为Al,⑥为S,⑦为Cl,⑧为Ar,⑨为K,⑩为Br,据此按要求回答即可;
(1)元素⑩名称为溴,在周期表中的位置第4周期第Ⅶ A族;
(2)元素非金属性越强,其最高价氧化物的水化物酸性越强,故在最高价氧化物的水化物中,酸性最强的化合物为高氯酸,其分子式是HClO4,碱性最强的化合物是KOH,电子式是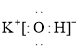 ;
;
(3)元素④与⑥形成的化合物为硫化钠,电子式为![]() ,该化合物属于离子化合物;
,该化合物属于离子化合物;
(4) 过氧化钠既有离子键又有非极性共价键的物质,其化学式Na2O2;
(5)⑥、⑦、⑨三种元素形成的离子,具有相同的电子层结构,核电荷数越大,离子半径越小,则离子半径由大到小的顺序是S2- > Cl- > K+。

【题目】在温度、初始容积相同的两个密闭容器中,按不同方式投入反应物![]() 如图所示
如图所示![]() ,发生反应:
,发生反应:![]() 保持温度不变,测得平衡时的有关数据如下:
保持温度不变,测得平衡时的有关数据如下:
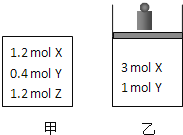
恒容容器甲 | 恒压容器乙 | |
Y的物质的量 |
|
|
Z的体积分数 |
|
|
下列说法正确的是![]()
A.平衡时容器乙的容积一定比反应前小
B.![]()
C.![]()
D.平衡时容器甲的压强一定比反应前大