题目内容
某待测液可能含有K+、NH4+、Ba2+、Cl-、CO32-、SO42-中的若干种离子.分别进行下述实验,以确定该溶液的组成.| 实验步骤 | 实验现象 | 实验结论 |
| ①取少量待测液,加入AgNO3溶液 | 有白色沉淀生成 | 待测液中Cl-离子______ (填“一定存在”、“一定不存在”或“不能确定”) |
| ②取100mL待测液,加足量浓NaOH溶液并加热 | 收集到气体约1.12L (已折算成标准状况下的体积) | 反应的离子方程式是 ______ 检出离子的物质的量浓度是 ______ |
| ③取100mL待测液,加足量BaCl2溶液后,对所得沉淀进行洗涤、干燥、称量;再向沉淀中加足量稀盐酸,然后干燥、称量 | 第一次称量白色沉淀质量为6.27g,第二次称量白色沉淀质量为2.33g | - |
| 实验分析:根据实验①~③,可判断待测液中一定存在的离子除K+离子外,还有的离子是______. 判断K+离子存在的理由是______. | ||
【答案】分析:①加入AgNO3溶液产生沉淀,可能存在Cl-、CO32-、SO42-;
②加足量浓NaOH溶液并加热产生气体,气体是氨气,一定存在铵离子;
③2.33g沉淀不溶于稀盐酸,一定是硫酸钡;6.27g沉淀中,溶于盐酸的是碳酸钡;
再根据溶液中的电荷关系,推断其他离子的情况.
解答:解 ①和硝酸银能够生成沉淀的离子有:Cl-、CO32-、SO42-;
故答案为:不能确定;
②产生的气体是氨气,物质的量为0.05mol,一定存在铵离子;反应的离子方程式是 NH4++OH-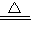 NH3↑+H2O;c(NH4+)=
NH3↑+H2O;c(NH4+)=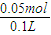 =0.5mol/L;
=0.5mol/L;
故答案为:NH4++OH-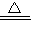 NH3↑+H2O 0.5mol/L;
NH3↑+H2O 0.5mol/L;
③2.33g沉淀不溶于稀盐酸,一定是硫酸钡;6.27g沉淀中,含有(6.27g-2.33g)=3.94g碳酸钡,物质的量为0.02mol;
根据以上推算,n(NH4+)=0.05mol,n(CO32-)=0.02mol,n(SO42-)=0.01mol,溶液中阴阳离子电荷守恒,CO32-和SO42-所带负电荷总数大于NH4+所带正电荷总数,故一定存在钾离子;故一定存在的离子有:K+、NH4+、CO32-、SO42-
故答案为:NH4+、CO32-、SO42-;数据计算n(NH4+)=0.05mol,n(CO32-)=0.02mol,n(SO42-)=0.01mol,根据溶液中阴阳离子电荷守恒CO32-和SO42-所带负电荷总数大于NH4+所带正电荷总数.
点评:本题考查了阴阳离子的检验,涉及了用电荷守恒推算离子的存在,要求显示做题时一定细致,难度适中.
②加足量浓NaOH溶液并加热产生气体,气体是氨气,一定存在铵离子;
③2.33g沉淀不溶于稀盐酸,一定是硫酸钡;6.27g沉淀中,溶于盐酸的是碳酸钡;
再根据溶液中的电荷关系,推断其他离子的情况.
解答:解 ①和硝酸银能够生成沉淀的离子有:Cl-、CO32-、SO42-;
故答案为:不能确定;
②产生的气体是氨气,物质的量为0.05mol,一定存在铵离子;反应的离子方程式是 NH4++OH-
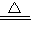 NH3↑+H2O;c(NH4+)=
NH3↑+H2O;c(NH4+)=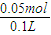 =0.5mol/L;
=0.5mol/L;故答案为:NH4++OH-
 NH3↑+H2O 0.5mol/L;
NH3↑+H2O 0.5mol/L;③2.33g沉淀不溶于稀盐酸,一定是硫酸钡;6.27g沉淀中,含有(6.27g-2.33g)=3.94g碳酸钡,物质的量为0.02mol;
根据以上推算,n(NH4+)=0.05mol,n(CO32-)=0.02mol,n(SO42-)=0.01mol,溶液中阴阳离子电荷守恒,CO32-和SO42-所带负电荷总数大于NH4+所带正电荷总数,故一定存在钾离子;故一定存在的离子有:K+、NH4+、CO32-、SO42-
故答案为:NH4+、CO32-、SO42-;数据计算n(NH4+)=0.05mol,n(CO32-)=0.02mol,n(SO42-)=0.01mol,根据溶液中阴阳离子电荷守恒CO32-和SO42-所带负电荷总数大于NH4+所带正电荷总数.
点评:本题考查了阴阳离子的检验,涉及了用电荷守恒推算离子的存在,要求显示做题时一定细致,难度适中.

练习册系列答案
相关题目
某待测液可能含有K+、NH4+、Ba2+、Cl-、CO32-、SO42-中的若干种离子.分别进行下述实验,以确定该溶液的组成.
| 实验步骤 | 实验现象 | 实验结论 |
| ①取少量待测液,加入AgNO3溶液 | 有白色沉淀生成 | 待测液中Cl-离子________ (填“一定存在”、“一定不存在”或“不能确定”) |
| ②取100mL待测液,加足量浓NaOH溶液并加热 | 收集到气体约1.12L (已折算成标准状况下的体积) | 反应的离子方程式是 ________ 检出离子的物质的量浓度是 ________ |
| ③取100mL待测液,加足量BaCl2溶液后,对所得沉淀进行洗涤、干燥、称量;再向沉淀中加足量稀盐酸,然后干燥、称量 | 第一次称量白色沉淀质量为6.27g,第二次称量白色沉淀质量为2.33g | - |
| 实验分析:根据实验①~③,可判断待测液中一定存在的离子除K+离子外,还有的离子是________. 判断K+离子存在的理由是________. | ||
 Ⅰ把由NaOH、AlCl3、MgCl2三种固体组成的混合物,溶于足量水中,有0.58g白色沉淀析出,向所得浊液中,逐滴加入1mol/L盐酸,加入盐酸的体积和生成沉淀的质量如图所示.
Ⅰ把由NaOH、AlCl3、MgCl2三种固体组成的混合物,溶于足量水中,有0.58g白色沉淀析出,向所得浊液中,逐滴加入1mol/L盐酸,加入盐酸的体积和生成沉淀的质量如图所示. NH3↑+H2O
NH3↑+H2O