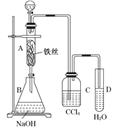
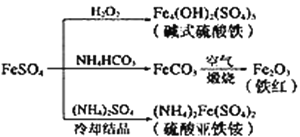
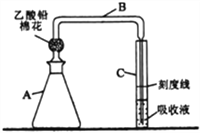
题目内容
【题目】下图是元素周期表的一部分
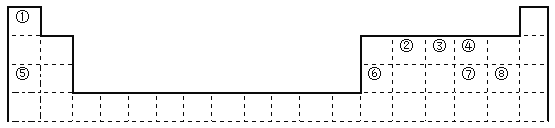
(1)表中最活泼的金属是______,非金属性最强的元素是______;(填写元素符号)
(2)②在元素周期表的位置是________________________。
(3)比较④、⑤常见简单离子的半径的大小(用化学式表示,下同)____________;⑦、⑧的最高价氧化物对应的水化物的酸性强弱是:____________。
(4)②③④三种元素都可以与元素①形成化合物,其稳定性顺序为___________________,其沸点由低到高的顺序为___________________(用化学式表示)。
(5)元素⑥的最高价氧化物的水化物与元素⑤⑦最高价氧化物的水化物都能发生反应,写出反应的离子方程式__________________________,________________________。
【答案】Na O 第二周期 ⅣA族 r(O2-)>r(Na+) HClO4>H2SO4 H2O>NH3>CH4 CH4﹤NH3﹤H2O Al(OH)3+3H+=Al3++3H2O Al(OH)3 +OH-=AlO2-+2H2O
【解析】
根据元素在周期表中的相对位置可知①~⑧分别是H、C、N、O、Na、Al、S、Cl,则
(1)根据元素周期律可知表中最活泼的金属是Na,非金属性最强的元素是O;(2)②是碳元素,在元素周期表的位置是第二周期ⅣA族。(3)核外电子排布相同时离子半径随原子序数的增大而减小,则④、⑤常见简单离子的半径的大小顺序为r(O2-)>r(Na+);氯元素非金属性强于硫元素,非金属性越强,最高价含氧酸的酸性越强,所以⑦、⑧的最高价氧化物对应的水化物的酸性强弱是HClO4>H2SO4。(4)非金属性越强,氢化物越稳定,则②③④三种元素形成的氢化物稳定性顺序为CH4<NH3<H2O,由于水分子间、氨气分子间均存在氢键,所以其沸点由低到高的顺序为H2O>NH3>CH4。(5)元素⑥的最高价氧化物的水化物氢氧化铝与元素⑤⑦最高价氧化物的水化物氢氧化钠、硫酸都能发生反应,反应的离子方程式分别是Al(OH)3+3H+=Al3++3H2O、Al(OH)3+OH-=AlO2-+2H2O。