题目内容
18.4 g由NaOH和NaHCO3组成的固体混合物,在密闭容器中加热到250 ℃,经充分反应后排出气体,冷却后称得剩余固体质量为16.6 g。试计算原混合物中NaOH的质量分数。
54.3%
解析:
假设NaHCO3与NaOH恰好完全反应时生成H2O的质量为x。
NaHCO3+NaOH![]() Na2CO3+H2O↑
Na2CO3+H2O↑
![]() 18
18
x
![]() ,x=2.67 g
,x=2.67 g
m(失重)=m(原)-m(剩),?
m(失重)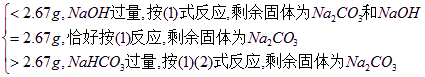
现已知m(失重)=18.4 g-16.6 g=1.8 g<2.67 g,故NaOH过量,按①式反应。
设原混合物中NaHCO3的质量为y。?
NaHCO3+NaOH![]() Na2CO3+H2O↑ Δm
Na2CO3+H2O↑ Δm
84 18
y 1.8 g
84∶18=y∶1.8,解得y=8.4 g
混合物中NaOH的质量分数为:
![]() ×100%=54.3%
×100%=54.3%

练习册系列答案
相关题目
 2NH3(g)△H=-92.2kJ/mol
2NH3(g)△H=-92.2kJ/mol






 I2+Z+H2O,其中的R元素.
I2+Z+H2O,其中的R元素.