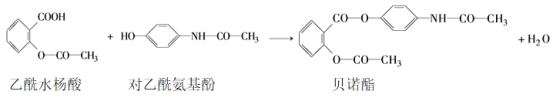
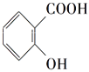
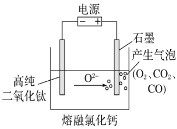
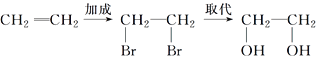题目内容
【题目】在体积固定的密闭容器中加入2mol A和1mol B,发生反应:2A(g)+B(g)![]() 3C(g)+D(g),达到平衡时C的浓度为a mol/L.若维持容器体积和温度不变,按下列四种配比作为起始物质,达到平衡后,C的浓度仍为a mol/L的是
3C(g)+D(g),达到平衡时C的浓度为a mol/L.若维持容器体积和温度不变,按下列四种配比作为起始物质,达到平衡后,C的浓度仍为a mol/L的是
A. 4 mol A+2 mol B B. 2 mol A+1 mol B+1 mol He
C. 3 mol C+2 mol D D. 2 mol A+1 mol D
【答案】B
【解析】
判断全等平衡的方法是将物质全部靠到一边进行极限转化,再与原反应进行比较来判断,若各物质与原来相等,则等效,否则不等效。因为反应前后体积是变化的,所以当容积不变时,要使C的物质的量的浓度仍然为amol/L,则起始物质的物质的量必须和最初的相同。
A项、4molA+2molB,这与这和题目开始不一样,故A错误;
B项、恒容条件下,充入不反应的稀有气体,不改变各组分的浓度,这和题目开始不一样,故B错误;
C项、采用极限分析法,3molC和2molD完全反应生成2molA和1molB,余下1molD,此时容器中共含有2molA、1molB和1molD,这和题目开始不一样,故C错误;
D项、2 mol A和1 mol D中没有反应物B,不能发生反应,故D产物。
故选B。

【题目】在一定温度下,10mL0.40mol/L H2O2发生催化分解。不同时刻测定生成O2的体积(已折算为标准状况)如下表。
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是(溶液体积变化忽略不计)
A.0~6min的平均反应速率:v(H2O2)![]()
![]() mol/(L·min)
mol/(L·min)
B.6~10min的平均反应速率:v(H2O2)<![]() mol/(L·min)
mol/(L·min)
C.反应至6min时,c(H2O2)=0.3mol/L
D.反应至6min时,H2O2分解了50%