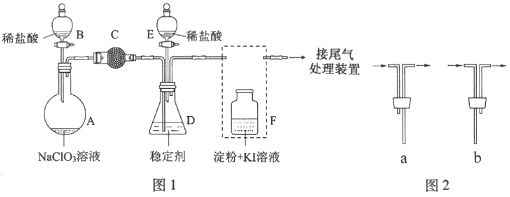
题目内容
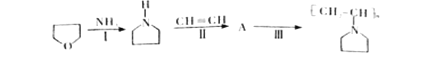
【题目】有机物A的结构简式为![]() ,它可通过不同化学反应分别制得B、C、D和E四种物质。请回答下列问题:
,它可通过不同化学反应分别制得B、C、D和E四种物质。请回答下列问题:
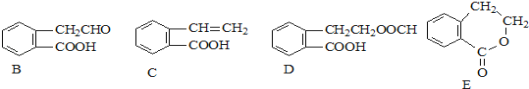
(1)在A~E五种物质中,互为同分异构体的是 (填代号)。
(2)写出由A生成D的化学方程式 。由A生成E的反应类型为 。
(3)已知HCHO分子中所有原子都在同一平面内,则在上述分子中所有的原子有可能都在同一平面的物质是 (填序号)。
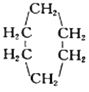
(4)C能形成高聚物,该高聚物的结构简式为 。
(5)写出一种区分D和E的试剂 。
【答案】(1)C和E (2) ![]() +HCOOH
+HCOOH![]() H2O+
H2O+![]()
酯化或取代反应 (3)C (4)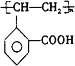 (5)NaHCO3溶液(或石蕊等合理即可)
(5)NaHCO3溶液(或石蕊等合理即可)
【解析】
试题分析:(1)分子式相同,而结构不同的化合物是互为同分异构体,则根据有机物的结构简式可知,在A~E五种物质中,互为同分异构体的是C和E,分子式都是C9H8O2。
(2)根据有机物的结构简式可知,A生成D是羟基与甲酸的酯化反应,反应的化学方程式为
![]() +HCOOH
+HCOOH![]() H2O+
H2O+![]() 。A生成E是羟基和羧基的酯化反应。
。A生成E是羟基和羧基的酯化反应。
(3)由于HCHO分子、苯分子中所有原子都在同一平面内,且碳碳双键也是平面型结构,所以在上述分子中所有的原子有可能都在同一平面的物质是C,而其余选项中都含有饱和碳原子,分子中的所有原子不可能处在同一平面内,答案选C。
(4)C分子中含有碳碳双键,能发生加聚反应,则生成物的结构简式是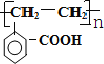 。
。
(5)根据有机物结构简式可知D和E均含有酯基,而D中还含有羧基,则检验D和E的试剂可以是碳酸氢钠溶液。

【题目】甲醇是重要的化工原料,又可称为燃料。工业上利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g)![]() CH3OH(g) △H
CH3OH(g) △H
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H=-58 kJ/mol
CH3OH(g)+H2O(g) △H=-58 kJ/mol
③CO2(g)+H2(g)![]() CO(g)+H2O(g) △H=+41 kJ/mol
CO(g)+H2O(g) △H=+41 kJ/mol
回答下列问题:
(1)已知反应①中的相关的化学键键能数据如下:
化学键 | H-H | C-O | C | H-O | C-H |
E/(kJ.mol-1) | 436 | 343 | 1076 | 465 | x |
则x=_________。
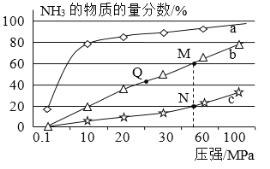
(2)若T℃时将6molCO2和8molH2充入2L密闭容器中发生反应②,测得H2的物质的量随时间变化如图中状态Ⅰ(图中实线)所示。图中数据A(1,6)代表在1min时H2的物质的量是6mol。

①T℃时状态Ⅰ条件下,0~3min内CH3OH的平均反应速率v=_____________mol/(L·min),平衡常数K=____;
②其他条件不变时,仅改变某一条件后测得H2的物质的量随时间变化如图中状态Ⅱ所示,则改变的条件可能是_______;
③其他条件不变,仅改变温度时,测得H2的物质的量随时间变化如图中状态Ⅲ所示,则状态Ⅲ对应的温度________(填“>”“<”或“=”)T℃;
④若状态Ⅱ的平衡常数为K2,状态Ⅲ的平衡常数为K3,则K2____(填“>”“<”或“=”)K3;
⑤一定温度下,此反应在恒容容器中进行,能判断该反应达到化学平衡状态依据的是_____。
a.容器中压强不变 b.甲醇和水蒸气的体积比保持不变
c.v正(H2)=3v逆(CH3OH) d.2个C=O断裂的同时有6个H—H断裂