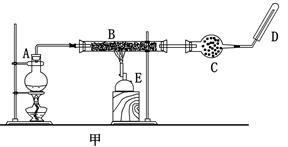
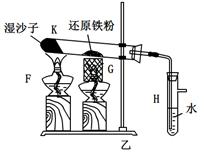
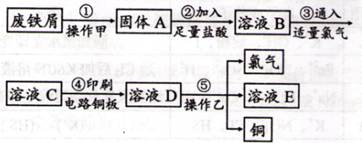
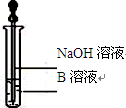
题目内容
将2.72g铁和氧化铁的混合物加入足量的盐酸中充分反应后,固体无剩余,测得反应后放出标准状况下气体0.224 L.则下列判断中正确的是
| A.原混合物中n(Fe)∶n(Fe2O3)=3∶1 |
| B.反应后溶液中Fe2+和Fe3+的物质的量之比为3∶1 |
| C.实际参加反应HCl的物质的量为0.08mol |
| D.向溶液中滴入KSCN溶液,显红色 |
C
试题分析:铁和氧化铁的混合物加入足量的盐酸中,发生反应:①Fe2O3+6HCl=2FeCl3+3H2O,② Fe+2FeCl3=3FeCl2.③Fe+2HCl=FeCl2+H2↑因为n(H2)=0.224L∕22.4L·mol-1=0.01mol。所以发生地三个反应消耗的铁是m(Fe)=0.56g其余固体恰好发生①②反应。由这两个方程式可得关系式是:Fe2O3- Fe。质量关系是160份氧化铁对应56份铁。而总质量是2.72g-0.56g=2.16g.所以m(Fe2O3)=1.6g即n(Fe2O3)=0.01mol发生②反应的铁质量为:m(Fe)="0.56g," n(Fe)=0.01mol铁原子总物质的量为n(Fe)=0.01+0.01+0.01×2=0.04mol。最后溶液是FeCl2溶液。n(Cl-)="2" n(Fe)=0.08mol。所以n(HCl)=n(Cl-)=0.08mol。C正确。A中原混合物中n(Fe)∶n(Fe2O3)=(0.01+0.01)∶0.01=2:1.错误。由于最后溶液是FeCl2溶液,不含氯化铁,向溶液中滴入KSCN溶液,也不显红色所以B错误,D 错误。

练习册系列答案
相关题目



 Fe(SCN)3具有反应迅速、现象明显等特点,是检验Fe3+常用的方法之一。某化学兴趣小组为探究Fe(SCN)3的性质,做了以下实验:
Fe(SCN)3具有反应迅速、现象明显等特点,是检验Fe3+常用的方法之一。某化学兴趣小组为探究Fe(SCN)3的性质,做了以下实验: 2FeCl2+CuCl2。现向FeCl3溶液中加入a g Cu粉,完全溶解后,再加入b g Fe粉,充分反应后尚有c g残余固体。若c<a,则下列说法正确的是
2FeCl2+CuCl2。现向FeCl3溶液中加入a g Cu粉,完全溶解后,再加入b g Fe粉,充分反应后尚有c g残余固体。若c<a,则下列说法正确的是