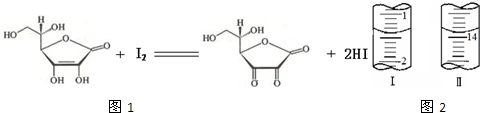
题目内容
高铁酸钾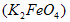 易溶于水,具有强氧化性,是一种新型水处理剂。工业上常用如下方法制备高铁酸钾:以铁丝网为阳极电解
易溶于水,具有强氧化性,是一种新型水处理剂。工业上常用如下方法制备高铁酸钾:以铁丝网为阳极电解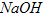 溶液,然后在阳极液中加入50%的KOH溶液,充分反应后,过滤、用异丙醇洗涤、干燥,即可制得。
溶液,然后在阳极液中加入50%的KOH溶液,充分反应后,过滤、用异丙醇洗涤、干燥,即可制得。
(1)高铁酸钾具有强氧化性的原因是___________________。
(2)用异丙醇代替水洗涤产品的好处是____________________。
(3)最近,工业上又用铁的氧化物代替铁丝网制备高铁酸盐,其优点是价廉易得且可提高电能的使用效率。则用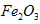 作阳极的电极反应式为________________;若通过相同的电流,分别用铁丝网、
作阳极的电极反应式为________________;若通过相同的电流,分别用铁丝网、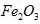 作阳极制得的高铁酸钾的质量之比为_____________。
作阳极制得的高铁酸钾的质量之比为_____________。
(4)探究高铁酸钾的某种性质。
【实验1】将适量K2FeO4固体分别溶解于pH 为 4.74、7.00、11.50 的水溶液中,配得FeO42-浓度为 1.0 mmol/L(1 mmol/L =10-3 mol/L)的试样,静置,考察不同初始 pH 的水溶液对K2FeO4某种性质的影响,结果见图1(注:800 min后,三种溶液中高铁酸钾的浓度不再改变)。
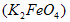 易溶于水,具有强氧化性,是一种新型水处理剂。工业上常用如下方法制备高铁酸钾:以铁丝网为阳极电解
易溶于水,具有强氧化性,是一种新型水处理剂。工业上常用如下方法制备高铁酸钾:以铁丝网为阳极电解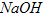 溶液,然后在阳极液中加入50%的KOH溶液,充分反应后,过滤、用异丙醇洗涤、干燥,即可制得。
溶液,然后在阳极液中加入50%的KOH溶液,充分反应后,过滤、用异丙醇洗涤、干燥,即可制得。(1)高铁酸钾具有强氧化性的原因是___________________。
(2)用异丙醇代替水洗涤产品的好处是____________________。
(3)最近,工业上又用铁的氧化物代替铁丝网制备高铁酸盐,其优点是价廉易得且可提高电能的使用效率。则用
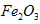 作阳极的电极反应式为________________;若通过相同的电流,分别用铁丝网、
作阳极的电极反应式为________________;若通过相同的电流,分别用铁丝网、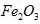 作阳极制得的高铁酸钾的质量之比为_____________。
作阳极制得的高铁酸钾的质量之比为_____________。(4)探究高铁酸钾的某种性质。
【实验1】将适量K2FeO4固体分别溶解于pH 为 4.74、7.00、11.50 的水溶液中,配得FeO42-浓度为 1.0 mmol/L(1 mmol/L =10-3 mol/L)的试样,静置,考察不同初始 pH 的水溶液对K2FeO4某种性质的影响,结果见图1(注:800 min后,三种溶液中高铁酸钾的浓度不再改变)。
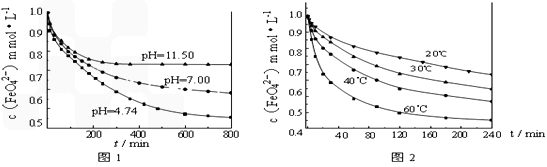
【实验2】将适量 K2FeO4溶解于pH=4.74 的水溶液中,配制成FeO42-浓度为 1.0 mmol/L的试样,将试样分别置于 20℃、30℃、40℃和60℃的恒温水浴中,考察不同温度对K2FeO4某种性质的影响,结果见图2。则
①实验1的目的是______________________;
②实验2可得出的结论是_____________________;
③高铁酸钾在水中的反应为4FeO42-+10H2O 4Fe(OH)3+8OH-+3O2↑。由图1可知,
4Fe(OH)3+8OH-+3O2↑。由图1可知,
800 min时,pH=11.50的溶液中高铁酸钾最终浓度比pH=4.74的溶液中高,主要原因是_____________________。
①实验1的目的是______________________;
②实验2可得出的结论是_____________________;
③高铁酸钾在水中的反应为4FeO42-+10H2O
 4Fe(OH)3+8OH-+3O2↑。由图1可知,
4Fe(OH)3+8OH-+3O2↑。由图1可知,800 min时,pH=11.50的溶液中高铁酸钾最终浓度比pH=4.74的溶液中高,主要原因是_____________________。
(1)其中的Fe元素为+6价,易得电子(或其他合理答案)
(2)减少洗涤时产品的损失且产品易干燥(或其他合理答案)
(3)Fe2O3+10OH--6e-=2FeO42-+5H2O;1∶2
(4)①研究FeO42-在不同pH溶液中的稳定性(或反应的速率);②温度越高,FeO42-越不稳定(或与水反应的速率越快);③pH=11.50的溶液中OH-离子浓度大,使平衡向左移动
(2)减少洗涤时产品的损失且产品易干燥(或其他合理答案)
(3)Fe2O3+10OH--6e-=2FeO42-+5H2O;1∶2
(4)①研究FeO42-在不同pH溶液中的稳定性(或反应的速率);②温度越高,FeO42-越不稳定(或与水反应的速率越快);③pH=11.50的溶液中OH-离子浓度大,使平衡向左移动

练习册系列答案
相关题目