题目内容
【题目】硼(B)可形成H3BO3、NaBH4、NaBO2等化合物,用途广泛。
(1)H3BO3为一元弱酸,常温下,在水中存在如下电离平衡:H3BO3 + H2O![]() [B(OH)4]-+H+,Ka=5.72×10-10。
[B(OH)4]-+H+,Ka=5.72×10-10。
①25℃时,0.175 mol/L的H3BO3溶液pH约为_________。
②已知碳酸H2CO3的电离平衡常数为Ka1 = 4.4×10-7,Ka2 = 4.7×10-11。将少量碳酸钠溶液滴加到饱和硼酸溶液中,反应的离子方程式为_________。
(2)在容积恒定为2 L的密闭容器中加入足量BPO4和Na固体并充入一定量的H2(g)发生储氢反应:BPO4(s)+4Na(s)+2H2(g)![]() Na3PO4(s)+NaBH4(s) △H<0
Na3PO4(s)+NaBH4(s) △H<0
①体系中H2的物质的量与反应时间的关系如表所示:
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
n(H2)/mol | 2.0 | 1.5 | 1.2 | 0.9 | 0.8 | 0.8 |
下列有关叙述正确的是(填标号)_________。
a. 当容器内气体的摩尔质量不再变化时,反应达到平衡状态
b. 10 min时向容器内通入少量H2,则重新达平衡前ν(放氢)> ν(吸氢)
c. 保持温度不变,平衡后再充入1 mol H2,达新平衡时H2的浓度为0.4 mol/L
d. 升高温度,放氢速率加快,重新达到平衡时容器压强增大
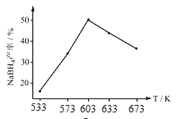
②图为产率与反应温度的关系曲线,NaBH4的产率在603K之前随温度升高而增大,在603K之后随温度升高而减小的原因是_________。
(3)NaBH4(s)遇H2O(l)剧烈水解,生成氢气和NaBO2(s)。
①通常状况下,实验测得3.8 g NaBH4(s)发生水解反应放出21.6 kJ热量,写出该反应的热化学方程式_________。
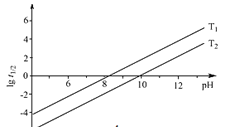
②![]() 为NaBH4水解的半衰期(水解一半所需要的时间,单位为min)。lg
为NaBH4水解的半衰期(水解一半所需要的时间,单位为min)。lg![]() 随pH和温度的变化如图所示。溶液pH=4时,NaBH4_________(填“能”或“不能”)稳定存在,原因是_________(用离子方程式表示);T1_________T2。(填 “>”或“<”)
随pH和温度的变化如图所示。溶液pH=4时,NaBH4_________(填“能”或“不能”)稳定存在,原因是_________(用离子方程式表示);T1_________T2。(填 “>”或“<”)
③硼氢化钠具有极强还原性,碱性条件可用于处理电镀废液中的CuSO4制得纳米铜,从而变废为宝。写出电镀阳极反应方程式_______________。
【答案】5 CO32-+H2O+H3BO3=HCO3-+[B(OH)4]- cd 603K之前,反应未达到平衡状态,温度升高,反应速率加快;603K之后达到平衡,随温度升高,平衡逆向移动 NaBH4(s)+2H2O(l)=NaBO2(s)+4H2(g) △H= -216kJ/mol 不能 BH4-+H++3H2O=H3BO3+4H2↑ < BH4- -8e-+8OH-=BO2-+6H2O
【解析】
(1)①利用电离常数表达式先计算出c(H+),再根据pH=-lgc(H+);
②根据电离平衡常数越大,溶液的酸性越强。强酸与弱酸的盐反应制取弱酸书写;
(2)①a.体系中只有H2一种气体,摩尔质量固定不变;
b.根据物质浓度对化学平衡移动移动分析;
c.根据化学平衡常数只与温度有关判断;
d.根据温度对化学反应速率和压强的影响分析;
②根据温度对化学反应速率和化学平衡移动的影响分析原因;
(3)①先书写反应方程式,然后根据物质变化与能量变化成正比,得到其相应的热化学方程式;
②NaBH4和酸反应生成硼酸和氢气;水解反应为吸热反应,升温促进水解正向进行;
③硼氢化钠具有极强还原性,电镀时BH4-在阳极失去电子,发生氧化反应。
(1)①根据电离平衡H3BO3 + H2O![]() [B(OH)4]-+H+可知Ka=
[B(OH)4]-+H+可知Ka=![]() =5.72×10-10,由于c(H3BO3)=0.175mol/L,所以c2(H+)=1×10-10,所以c(H+)=1×10-5mol/L,溶液的pH=5;
=5.72×10-10,由于c(H3BO3)=0.175mol/L,所以c2(H+)=1×10-10,所以c(H+)=1×10-5mol/L,溶液的pH=5;
②由于H3BO3的电离平衡常数是5.72×10-10,二元弱酸H2CO3的电离平衡常数Ka1 = 4.4×10-7,Ka2 = 4.7×10-11,所以酸性:H2CO3> H3BO3>HCO3-。将少量碳酸钠溶液滴加到饱和硼酸溶液中,反应的离子方程式为CO32-+H2O+H3BO3=HCO3-+[B(OH)4]-;
(2)①a.根据反应方程式可知:体系中只有H2一种气体,所以无论是否达到平衡状态,体系的摩尔质量都不变,因此不能据此判断反应是否处于平衡状态,a错误;
b.由表中数据可知,该反应在10 min时已达平衡,在其它条件不变时,通入氢气,使反应物浓度增大,化学平衡正向移动,重新达平衡前ν(吸氢) >ν(放氢),b错误;
c.该反应的化学平衡常数K=![]() ,温度不变,化学平衡常数不变,所以保持温度不变,平衡后再充入1 mol H2,达新平衡时H2的浓度仍为0.4 mol/L,c正确;
,温度不变,化学平衡常数不变,所以保持温度不变,平衡后再充入1 mol H2,达新平衡时H2的浓度仍为0.4 mol/L,c正确;
d.由于该反应为放热反应,在其它条件不变时,升高温度,化学反应速率加快,平衡向逆反应方向移动,氢气的物质的量增大,体系的压强增大,d正确;
故合理选项是cd;
②在603K之前,反应正向进行,反应未达到平衡状态,温度升高,反应速率加快,更多的反应物转化为生成物,反应物的转化率增大;603K之后达到平衡,由于该反应的正反应是放热反应,随着温度的升高,化学平衡向吸热的逆反应移动,导致反应物的转化率降低;
(3)①n(NaBH4)=3.8g÷38g/mol=0.1mol,反应放出热量是21.6 kJ,则1mol固态NaBH4与水反应产生固态NaBO2和氢气,放出热量是216kJ,故其热化学方程式为:NaBH4(s)+2H2O(l)=NaBO2(s)+4H2(g) △H= -216kJ/mol;
②NaBH4可水解放出氢气,反应方程式为:NaBH4+2H2O═NaBO2+4H2↑,在酸性条件下,NaBH4不能稳定性存在,NaBH4和酸反应生成硼酸和氢气,反应的离子方程式为:BH4-+H++3H2O=H3BO3+4H2↑,温度越高化学反应速率越大,半衰期越短,所以T1<T2;
③硼氢化钠具有极强还原性,碱性条件可用于处理电镀废液中的CuSO4制得纳米铜,从而变废为宝。电镀时BH4-在阳极失去电子,发生氧化反应,阳极反应式为:BH4- -8e-+8OH-=BO2-+6H2O。

 阅读快车系列答案
阅读快车系列答案