题目内容
【题目】铁和铝是日常生活中用途广泛的金属。
I.(1)向NaAlO2溶液中滴加AlCl3溶液,生成白色胶状沉淀,则发生反应的离子方程式为_________________________。
(2)实验室常用还原性 Fe 粉与水蒸气反应的实验来研究 Fe 的还原性,则该反应的化学方程式为_________________________。
(3)电子工业用FeCl3溶液腐蚀敷在绝缘板上的铜制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式:__________________________。
II.已知合金A由两种常见金属组成。为测定其组成,某同学的实验流程如图所示:
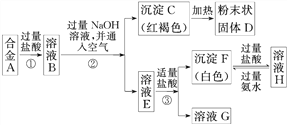
请回答:
(4)溶液E中所含的溶质是_________________(写化学式)
(5)合金A中的一种金属可以与粉末状固体D在高温下反应生成合金A中的另一种金属,请写出该反应的化学方程式_____________________________。
【答案】3AlO2- + Al3+ + 6H2O = 4Al(OH)3↓3Fe+4H2O(g)![]() Fe3O4+4H22Fe3++Cu=2Fe2++Cu2+NaAlO2、NaOH、NaCl2Al+Fe2O3
Fe3O4+4H22Fe3++Cu=2Fe2++Cu2+NaAlO2、NaOH、NaCl2Al+Fe2O3![]() Al2O3+2Fe
Al2O3+2Fe
【解析】I.(1)向NaAlO2溶液中滴加AlCl3溶液,发生双水解反应,生成氢氧化铝沉淀,反应的离子方程式为3AlO2- + Al3+ + 6H2O = 4Al(OH)3↓,故答案为:3AlO2- + Al3+ + 6H2O = 4Al(OH)3↓;
(2)还原性 Fe 粉与水蒸气反应删除四氧化三铁和氢气,反应的化学方程式为3Fe+4H2O(g)![]() Fe3O4+4H2,故答案为:3Fe+4H2O(g)
Fe3O4+4H2,故答案为:3Fe+4H2O(g)![]() Fe3O4+4H2;
Fe3O4+4H2;
(3)FeCl3溶液与铜反应的离子方程式为2Fe3++Cu=2Fe2++Cu2+,故答案为:2Fe3++Cu=2Fe2++Cu2+;
II.已知合金A由两种常见金属组成,加入过量盐酸反应得到溶液B,加入过量氢氧化钠溶液并通入空气,过滤得到红褐色沉淀,判断为Fe(OH)3,加热分解得到粉末状固体D为氧化铁,则确定原来金属有Fe,滤液E加入少量盐酸生成白色沉淀F和溶液G,白色沉淀F加入过量盐酸溶解得到溶液H,溶液H加入过量氨水又生成白色沉淀F,确定白色沉淀F为氢氧化铝沉淀,溶液H为过量盐酸和AlCl3溶液,溶液G为偏铝酸钠和氯化钠的混合溶液,溶液E为NaAlO2溶液,其中还含有氯化钠和过量的氢氧化钠,溶液B为氯化亚铁和氯化铝的混合溶液,金属为Fe,Al。
(4)根据上述分析可知溶液E中所含的溶质是NaAlO2、NaOH、NaCl,故答案为:NaAlO2、NaOH、NaCl;
(5)合金A中的一种金属可以与粉末状固体D在高温下反应生成合金A中的另一种金属,反应的化学方程式2Al+Fe2O3![]() Al2O3+2Fe,故答案为:2Al+Fe2O3
Al2O3+2Fe,故答案为:2Al+Fe2O3![]() Al2O3+2Fe;
Al2O3+2Fe;

 阅读快车系列答案
阅读快车系列答案