题目内容
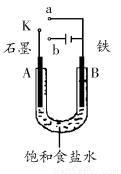
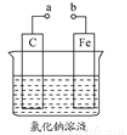
如图所示甲、乙两个装置,所盛溶液体积和浓度均相同且足量,当两装置电路中通过的电子都是1 mol时,下列说法不正确的是( )
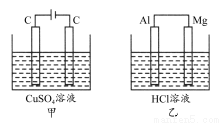
A.溶液的质量变化:甲减小乙增大
B.溶液pH变化:甲减小乙增大
C.相同条件下产生气体的体积:V甲=V乙
D.电极反应式:甲中阴极为Cu2++2e-=Cu,乙中负极为Mg-2e-=Mg2+
C
【解析】甲中总反应为2CuSO4+2H2O 2Cu+2H2SO4+O2↑,乙中总反应为Mg+2HCl=MgCl2+H2↑,故甲溶液质量减小,乙溶液质量增大,A对;甲中生成H2SO4,pH减小,乙中消耗盐酸,pH增大,B对;当两装置电路中通过的电子都是1 mol时,甲中产生0.25 mol O2,乙中产生0.5 mol H2,故相同条件下,甲乙中产生气体的体积比为1:2,C错;甲中阴极为Cu2+放电,电极反应为Cu2++2e-=Cu,乙中负极为Mg放电,电极反应为Mg-2e-=Mg2+,D对。
2Cu+2H2SO4+O2↑,乙中总反应为Mg+2HCl=MgCl2+H2↑,故甲溶液质量减小,乙溶液质量增大,A对;甲中生成H2SO4,pH减小,乙中消耗盐酸,pH增大,B对;当两装置电路中通过的电子都是1 mol时,甲中产生0.25 mol O2,乙中产生0.5 mol H2,故相同条件下,甲乙中产生气体的体积比为1:2,C错;甲中阴极为Cu2+放电,电极反应为Cu2++2e-=Cu,乙中负极为Mg放电,电极反应为Mg-2e-=Mg2+,D对。

练习册系列答案
 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案
相关题目
某些化学键键能数据如下:
化学键 | H—H | Cl—Cl | H—Cl |
键能/ kJ·mol-1 | 436 | 243 | 431 |
则下列热化学方程式不正确的是( )
A. 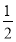 H2(g)+
H2(g)+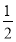 Cl2(g)=HCl(g) ΔH=-91.5 kJ·mol-1
Cl2(g)=HCl(g) ΔH=-91.5 kJ·mol-1
B.H2(g)+Cl2(g)=2HCl(g)ΔH=-183 kJ·mol-1
C. 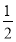 H2(g)+
H2(g)+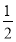 Cl2(g)=HCl(g)ΔH=+91.5 kJ·mol-1
Cl2(g)=HCl(g)ΔH=+91.5 kJ·mol-1
D.2HCl(g)=H2(g)+Cl2(g)ΔH=+183 kJ·mol-1