题目内容
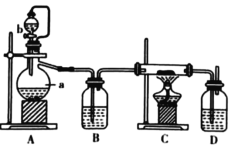
【题目】实验室以电石(主要成分是CaC2)为原理制备乙炔,装置如图所示。完成下列填空:

(1)仪器A的名称是______________。
(2)实验室制取乙炔的化学方程式为:___________________________________ 。
(3)为避免电石和水反应过于激烈,除用饱和食盐水代替水外,还需采取的措施是:__________。
(4)为除去乙炔中混有的少量硫化氢杂质,可将气体通过____________(选填编号)。
a.酸性KMnO4溶液 b.CCl4 c.NaOH溶液
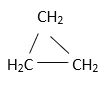
(5)乙炔属于_______________(填“饱和烃”或“不饱和烃)。
【答案】圆底烧瓶 CaC2+2H2O→Ca(OH)2+C2H2↑ 控制分液漏斗的活塞,使液体缓慢滴下 c 不饱和烃
【解析】
(1)根据仪器的构造可知,仪器A的名称是圆底烧瓶;
(2)实验室制备乙炔利用碳化钙和水反应生成乙炔和氢氧化钙,反应为CaC2+2H2O→Ca(OH)2+C2H2↑;
(3)碳化钙和水之间的反应十分剧烈,为减慢反应速率,可以将水换成饱和食盐水,可以利用分液漏斗的活塞调节滴加饱和食盐水的速率,以减慢化学反应速率,
故答案为:控制分液漏斗的活塞,使液体缓慢滴下;
(4)a.酸性KMnO4溶液能氧化硫化氢,也能氧化乙炔为二氧化碳,选项a错误;
b.四氯化碳不吸收硫化氢,与乙炔不反应,选项b错误;
c.氢氧化钠和硫化氢反应生成硫化钠和水,氢氧化钠和乙炔不反应,选项c正确;
故答案为:c;
(5)乙炔中含有碳碳三键,属于不饱和烃。

 阅读快车系列答案
阅读快车系列答案【题目】如图是实验室制备氯气并进行一系列相关实验的装置(夹持及加热仪器已略)。
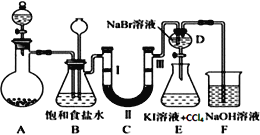
(1)装置B中饱和食盐水的作用是__;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象___。
(2)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入___。(填序号)
a | b | c | d | |
Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
(4)工业上将氯气通入石灰乳制取漂白粉,化学反应方程式为__,漂白粉敞放于空气中会失效,请写出失效所发生反应的化学方程式___。