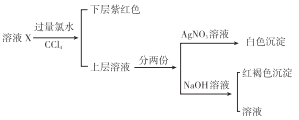
题目内容
【题目】常温下,1 mol化学键断裂形成气态原子所需要的能量用 ![]() 表示。结合表中信息判断下列说法不正确的是( )
表示。结合表中信息判断下列说法不正确的是( )
共价键 | H-H | F-F | H-F | H-Cl | H-I |
E (kJ/mol) | 436 | 157 | 568 | 432 | 298 |
A. 1 mol H2和1 mol F2完全反应时,释放25 kJ能量
B. 表中最稳定的共价键是H-F键
C. 1 mol H2转化为H原子时,吸收436 kJ能量
D. 432 kJ/mol > E (H-Br) > 298 kJ/mol
【答案】A
【解析】
A、依据键能计算反应焓变=反应物键能总和-生成物键能总和计算判断.
B、键能越大形成的化学键越稳定;
C、H-H的键能436kJ/mol,1 mol H2转化为H原子时,吸收436 kJ能量;
D、依据溴原子半径大于氯原子小于碘原子,半径越大键能越小分析推断;
A、依据键能计算反应焓变=反应物键能总和-生成物键能总和计算判断,△H=436kJ·mol-1+157kJ·mol-1-2×568kJ·mol-1=-543kJ·mol-1,H2(g)+F2(g)=2HF(g) △H=-543 kJ·mol-1,1 mol H2和1 mol F2完全反应时,释放543 kJ能量,故A错误;
B、键能越大形成的化学键越稳定,表中键能最大的是H-F,最稳定的共价键是H-F键,故B正确;
C、H-H的键能436kJ/mol,1 mol H2转化为H原子时,吸收436 kJ能量,故C正确;
D、依据溴原子半径大于氯原子小于碘原子,半径越大键能越小分析,所以结合图表中数据可知432 kJ·mol-1>E(H-Br)>298 kJ·mol-1,故D正确;
故选A。

【题目】下表为元素周期表的一部分,表中列出11种元素在周期表中的位置,按要求回答下列各题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ⑥ | ⑧ | ||||||
3 | ① | ③ | ⑤ | ⑦ | ⑨ | |||
4 | ② | ④ | ⑩ |
(1)这11种元素中,化学性质最不活泼的元素是______(填元素符号,下同),失电子能力最强的原子是______,得电子能力最强的单质与水反应的化学方程式是______________,常温下单质为液态的非金属单质是____________;
(2)⑦⑧⑨气氢化物的稳定性:________>________>________
(3)写出③的单质置换出⑥的单质的化学方程式:__________________;
①和⑤两种元素最高价氧化物对应的水化物相互反应的化学方程式为_____________;
⑨的最高价氧化物对应水化物的水溶液与⑤的最高价氧化物反应的离子方程式为________。