题目内容
在密闭容器中反应:aX(g)+bY(g)?cZ(g)+dW(g),反应达到平衡后,保持温度不变,将气体压缩到原来的一半体积,当再次达到平衡时,W的浓度为原平衡的1.8倍.下列叙述不正确的是( )
分析:保持温度不变,将气体压缩到原来的一半体积,如平衡不移动,则应有W的浓度为原平衡的2倍,而此时为1.8倍,说明增大压强平衡向逆反应方向移动,以此解答该题.
解答:解:保持温度不变,将气体压缩到原来的一半体积,如平衡不移动,则应有W的浓度为原平衡的2倍,而此时为1.8倍,说明增大压强平衡向逆反应方向移动,则应有a+b<c+d,Z的体积分数减小,X的转化率下降.
故选A.
故选A.
点评:本题考查化学平衡的影响因素,注意根据增大压强浓度的变化判断平衡移动的方向,为解答该题的关键,题目难度不大.

练习册系列答案
 发散思维新课堂系列答案
发散思维新课堂系列答案
相关题目
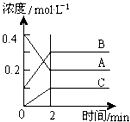 如图所示为800℃时A、B、C三种气体在密闭容器中反应时浓度的变化,只从图上分析不能得出的结论是( )
如图所示为800℃时A、B、C三种气体在密闭容器中反应时浓度的变化,只从图上分析不能得出的结论是( )