题目内容
“温室效应”是哥本哈根气候变化大会研究的环境问题之一。CO2是目前大气中含量最高的一种温室气体。因此,控制和治理CO2是解决“温室效应”的有效途径。
(1)下列措施中,有利于降低大气中CO2浓度的有 (填字母)。
A.采用节能技术,减少化石燃料的用量
B.鼓励乘坐公交车出行,倡导低碳生活
C.利用太阳能、风能等新型能源替代化石燃料
(2)一种途径是将CO2转化成有机物实现碳循环。如:
2CO2(g)+2H2O(l)=C2H4(g)+3O2(g) △Hl=+1411.0 kJ/mol
2CO2(g)+3H2O(l)=C2H5OH(l)+3O2(g) △H2=+1366.8 kJ/mol
则由乙烯水化制乙醇的热化学方程式是 。
(3)在一定条件下,6H2(g)+2CO2(g) CH3CH2OH(g)+3H2O(g)。
CH3CH2OH(g)+3H2O(g)。
|
温度(K) CO2转化率(%) n(H2)/n(CO2) |
500 |
600 |
700 |
800 |
|
1.5 |
45 |
33 |
20 |
12 |
|
2 |
60 |
43 |
28 |
15 |
|
3 |
83 |
62 |
37 |
22 |
根据上表中数据分析:
①温度一定时,提高氢碳比[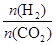 ],CO2的转化率
(填“增大”“减小”或“不变”)。
],CO2的转化率
(填“增大”“减小”或“不变”)。
②该反应的正反应为 (填“吸”或“放”)热反应。
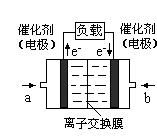
(4)下图是乙醇燃料电池(电解质溶液为KOH溶液)的结构示意图,则b处通入的是 (填“乙醇”或“氧气”),a处发生的电极反应是 。
(1)abc(2分)
(2)C2H4(g)+H2O(l)=C2H5OH(l) △H=-44.2 kJ/mol(2分)
(3)①增大(2分)②放(2分)
(4)氧气(2分);CH3CH2OH+16OH--12e-===2CO32-+11H2O(2分)
【解析】
试题分析:(1)a.采用节能技术能减少化石燃料的使用,减少化石燃料的使用就减少了二氧化碳的排放,所以正确;
b.化石燃料燃烧产物是二氧化碳,减少化石燃料的使用就减少了二氧化碳的排放,所以正确.
c.利用太阳能、风能能减少化石燃料的使用,化石燃料燃烧产物是二氧化碳,减少化石燃料的使用就减少了二氧化碳的排放,所以正确;故选abc;
(2)2CO2(g)+2H2O(l)═C2H4(g)+3O2(g)△H=+1411.0kJ/mol①
2CO2(g)+3H2O(l)═C2H5OH(l)+3O2(g)△H=+1366.8kJ/mol②
将方程式②-①得C2H4(g)+H2O(l)═C2H5OH(l)△H=+1366.8kJ/mol-(+1411.0kJ/mol)=-44.2kJ/mol;
(3)①温度一定时,提高氢碳比(3)①温度一定时,提高氢碳比[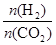 ],相当于增加氢气的量,增加氢气的量能够使二氧化碳的转化率增大;
],相当于增加氢气的量,增加氢气的量能够使二氧化碳的转化率增大;
②从表中数据看出:温度越高,二氧化碳的转化率越小,升高温度化学平衡向着吸热方向,即向着使二氧化碳的转化率减小的方向(逆向)进行,故正向是放热反应;
(4)根据电子流向知,a电极是负极,b电极是正极,负极上燃料乙醇失电子发生氧化反应,正极上氧化剂得电子发生还原反应,所以b处是氧气,b处的电极反应式为:O2+2H2O+4e-═4OH-,
考点:考查考查了原电池原理、压强对化学平衡的影响等知识点。

 口算题天天练系列答案
口算题天天练系列答案(16分)“温室效应”是哥本哈根气候变化大会研究的环境问题之一,CO2是目前大气中含量最高的一种温室气体。因此,控制和治理CO2是解决“温室效应”的有效途径。
(1)下列措施中,有利于降低大气中CO2浓度的有 (填字母编号)。
a.采用节能技术,减少化石燃料的用量 b.鼓励乘坐公交车出行,倡导低碳生活
c.利用太阳能、风能等新型能源替代化石燃料
(2)另一种途径是将CO2转化成有机物实现碳循环。如:
2CO2(g)+2H2O(l) = C2H4(g)+3O2(g)
ΔH=+1411.0 kJ/mol
2CO2(g)+3H2O(l) = C2H5OH(1)+3O2(g) 错误!未找到引用源。ΔH=+1366.8kJ/mol
则由乙烯水化制乙醇的热化学方程式是 。
(3)在一定条件下,6H2(g) +2CO2(g) CH3CH2OH(g)+3H2O(g)。
|
n(H2)/n(CO2) | 500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2 | 60 | 43 | 28 | 15 |
| 3 | 83 | 62 | 37 | 22 |
根据上表中数据分析:
①温度一定时,提高氢碳比[n(H2)/n(CO2)],CO2的转化率 (填“增大”、“减小”或“不变”)。
②该反应的正反应为 (填“吸热”或“放热”)反应。
③在答卷的坐标系中作图,说明压强由p1增大到p2时,压强对该反应化学平衡的影响(图中纵坐标所表示的物理量需自己定义)。
(16分)“温室效应”是哥本哈根气候变化大会研究的环境问题之一,CO2是目前大气中含量最高的一种温室气体。因此,控制和治理CO2是解决“温室效应”的有效途径。
(1)下列措施中,有利于降低大气中CO2浓度的有 (填字母编号)。
a.采用节能技术,减少化石燃料的用量 b.鼓励乘坐公交车出行,倡导低碳生活
c.利用太阳能、风能等新型能源替代化石燃料
(2)另一种途径是将CO2转化成有机物实现碳循环。如:
2CO2(g)+2H2O(l) =C2H4(g)+3O2(g)
ΔH=+1411.0 kJ/mol
2CO2(g)+3H2O(l) = C2H5OH(1)+3O2(g) 错误!未找到引用源。ΔH=+1366.8 kJ/mol
则由乙烯水化制乙醇的热化学方程式是 。
(3)在一定条件下,6H2(g) +2CO2(g) CH3CH2OH(g)+3H2O(g)。
CH3CH2OH(g)+3H2O(g)。
 CO2转化率(%) CO2转化率(%)n(H2)/n(CO2) | 500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2 | 60 | 43 | 28 | 15 |
| 3 | 83 | 62 | 37 | 22 |
①温度一定时,提高氢碳比[n(H2)/n(CO2)],CO2的转化率 (填“增大”、“减小”或“不变”)。
②该反应的正反应为 (填“吸热”或“放热”)反应。
③在答卷的坐标系中作图,说明压强由p1增大到p2时,压强对该反应化学平衡的影响(图中纵坐标所表示的物理量需自己定义)。
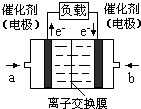 氧气”),b处电极上发生的电极反应是:
氧气”),b处电极上发生的电极反应是: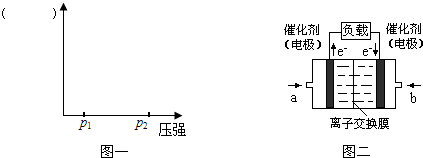
 CO2转化率(%)
CO2转化率(%)