题目内容
用脱脂棉包住0.78g Na2O2粉末,置于石棉网上,往脱脂棉上滴1mL水,可观察到脱脂棉剧烈燃烧起来.
(1)由实验现象可得出的结论:Na2O2与H2O反应有氧气生成且反应为
(2)如果用嘴通过细管向脱脂棉中吹气,脱脂棉也能燃烧起来,试写出反应的化学方程式:
(3)H2和CO的混合气体0.02g通入一盛有0.78g Na2O2的密闭容器中,再通入过量O2,并用电火花引燃使其充分反应,容器中固体增加的质量为
(1)由实验现象可得出的结论:Na2O2与H2O反应有氧气生成且反应为
2Na2O2+2H2O=4NaOH+O2↑
2Na2O2+2H2O=4NaOH+O2↑
反应.(2)如果用嘴通过细管向脱脂棉中吹气,脱脂棉也能燃烧起来,试写出反应的化学方程式:
2Na2O2+2H2O=4NaOH+O2↑
2Na2O2+2H2O=4NaOH+O2↑
、2Na2O2+2CO2=2Na2CO3+O2↑
2Na2O2+2CO2=2Na2CO3+O2↑
;若向脱脂棉中吹入的是SO2气体,脱脂棉不能
不能
(填“能”或“不能”)燃烧起来.(3)H2和CO的混合气体0.02g通入一盛有0.78g Na2O2的密闭容器中,再通入过量O2,并用电火花引燃使其充分反应,容器中固体增加的质量为
0.02
0.02
g.分析:燃烧的条件是:(1)物质具有可燃性,(2)可燃物与氧气接触,(3)温度达到可燃物的着火点,根据燃料燃烧的条件分析;
(1)过氧化钠和水反应生成氢氧化钠和氧气;
(2)吹出的气体中含有大量水蒸气和CO2,CO2也能与Na2O2反应,该反应也属于放热反应且有O2生成,写出水和过氧化钠反应和二氧化碳与过氧化钠反应的化学方程式;
SO2与Na2O2反应无助燃气体O2产生(SO2+Na2O2═Na2SO4),所以不能燃烧;
(3)CO燃烧生成二氧化碳与水,反应方程式为2CO+O2═2CO2,二氧化碳与过氧化钠发生反应2CO2+2Na2O2=2Na2CO3+O2,方程式相加的CO+Na2O2=Na2CO3,固体增加的质量为相当于CO的质量;
氢气燃烧生成水,反应方程式为2H2+O2═2H2O,水与过氧化钠发生反应2H2O+2Na2O2=4NaOH+O2,二者相加可得H2+Na2O2=2NaOH,固体增加的质量为相当于H2的质量.
固体质量的增加量就是原混合气体中CO、H2的质量和,据此计算.
(1)过氧化钠和水反应生成氢氧化钠和氧气;
(2)吹出的气体中含有大量水蒸气和CO2,CO2也能与Na2O2反应,该反应也属于放热反应且有O2生成,写出水和过氧化钠反应和二氧化碳与过氧化钠反应的化学方程式;
SO2与Na2O2反应无助燃气体O2产生(SO2+Na2O2═Na2SO4),所以不能燃烧;
(3)CO燃烧生成二氧化碳与水,反应方程式为2CO+O2═2CO2,二氧化碳与过氧化钠发生反应2CO2+2Na2O2=2Na2CO3+O2,方程式相加的CO+Na2O2=Na2CO3,固体增加的质量为相当于CO的质量;
氢气燃烧生成水,反应方程式为2H2+O2═2H2O,水与过氧化钠发生反应2H2O+2Na2O2=4NaOH+O2,二者相加可得H2+Na2O2=2NaOH,固体增加的质量为相当于H2的质量.
固体质量的增加量就是原混合气体中CO、H2的质量和,据此计算.
解答:解:脱脂棉剧烈燃烧说明具备燃烧的条件,试管内空气较少,若剧烈燃烧应该有大量氧气,只有该反应是放热反应才能使燃料温度达到着火点,根据题意知该反应有氧气生成且放热;
(1)脱脂棉能燃烧,说明Na2O2与H2O的反应属于放热反应.过氧化钠和水反应生成氢氧化钠和氧气,方程式为2Na2O2+2H2O=4NaOH+O2↑,
故答案为:2Na2O2+2H2O=4NaOH+O2↑;
(2)吹出的气体中含有大量水蒸气和CO2,CO2也能与Na2O2反应,该反应也属于放热反应且有O2生成,写出水和过氧化钠反应和二氧化碳与过氧化钠反应的化学方程式为2H2O+2Na2O2=4NaOH+O2,2CO2+2Na2O2=2Na2CO3+O2;SO2与Na2O2反应无助燃气体O2产生(SO2+Na2O2=Na2SO4),所以不能燃烧;
故答案为:2CO2+2Na2O2=2Na2CO3+O2;2CO2+2Na2O2=2Na2CO3+O2;不能;
(3)CO燃烧生成二氧化碳与水,反应方程式为2CO+O2═2CO2,二氧化碳与过氧化钠发生反应2CO2+2Na2O2=2Na2CO3+O2,方程式相加的CO+Na2O2=Na2CO3,固体增加的质量为相当于CO的质量;
氢气燃烧生成水,反应方程式为2H2+O2═2H2O,水与过氧化钠发生反应2H2O+2Na2O2=4NaOH+O2,二者相加可得H2+Na2O2=2NaOH,固体增加的质量为相当于H2的质量.
所以固体质量的增加量就是原混合气体中CO、H2的质量和;
故答案为:0.02g.
(1)脱脂棉能燃烧,说明Na2O2与H2O的反应属于放热反应.过氧化钠和水反应生成氢氧化钠和氧气,方程式为2Na2O2+2H2O=4NaOH+O2↑,
故答案为:2Na2O2+2H2O=4NaOH+O2↑;
(2)吹出的气体中含有大量水蒸气和CO2,CO2也能与Na2O2反应,该反应也属于放热反应且有O2生成,写出水和过氧化钠反应和二氧化碳与过氧化钠反应的化学方程式为2H2O+2Na2O2=4NaOH+O2,2CO2+2Na2O2=2Na2CO3+O2;SO2与Na2O2反应无助燃气体O2产生(SO2+Na2O2=Na2SO4),所以不能燃烧;
故答案为:2CO2+2Na2O2=2Na2CO3+O2;2CO2+2Na2O2=2Na2CO3+O2;不能;
(3)CO燃烧生成二氧化碳与水,反应方程式为2CO+O2═2CO2,二氧化碳与过氧化钠发生反应2CO2+2Na2O2=2Na2CO3+O2,方程式相加的CO+Na2O2=Na2CO3,固体增加的质量为相当于CO的质量;
氢气燃烧生成水,反应方程式为2H2+O2═2H2O,水与过氧化钠发生反应2H2O+2Na2O2=4NaOH+O2,二者相加可得H2+Na2O2=2NaOH,固体增加的质量为相当于H2的质量.
所以固体质量的增加量就是原混合气体中CO、H2的质量和;
故答案为:0.02g.
点评:本题考查了过氧化钠和水反应的实验,难度不大,解答时要从实验现象方面进行分析、判断,从而得出正确的结论.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
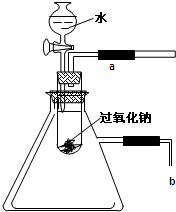 用脱脂棉包住0.2g过氧化钠粉末,置于石棉网上,往脱脂棉上滴几滴水,可观察到脱脂棉剧烈燃烧起来.
用脱脂棉包住0.2g过氧化钠粉末,置于石棉网上,往脱脂棉上滴几滴水,可观察到脱脂棉剧烈燃烧起来.