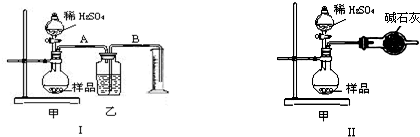
题目内容
某校化学兴趣小组的同学欲测定某种品牌纯碱中食盐的含量。
①称取某纯碱样品10.0 g放入烧杯中,并加适量蒸馏水使之完全溶解。
②____________________________________。
③____________________________________。
④用蒸馏水洗涤沉淀2—3次。
⑤将沉淀烘干、称量,测得固体质量2.87 g。
(1)补齐所缺少的实验步骤,将答案填写在上面②和③的空格处。
(2)实验步骤③所用的玻璃仪器有:____________________________________。
(3)在过滤器上洗涤沉淀的具体操作是:____________________________________。
(4)检验沉淀是否洗涤干净的方法是:____________________________________。
(5)若纯碱标签上标注:“Na2CO3含量≥80.0%,NaCl含量≤20.0%”,则此样品是否合格?________(填“合格”或“不合格”)。
(1)②加入硝酸酸化的硝酸银溶液于样品溶液中,直到不再产生沉淀为止③将②所得溶液过滤
(2)漏斗、玻璃棒、烧杯
(3)向漏斗里注入蒸馏水,使水面浸过沉淀物,等水流完后,重复操作2—3次
(4)取最后几滴洗出液加稀盐酸,若无浑浊现象,说明沉淀已洗净
(5)合格
解析:
实验目的的是“测定纯碱(Na2CO3)中食盐(NaCl)的含量”。
首先,分析该实验是测碳酸盐沉淀还是氯化物沉淀。因为样品质量是10.0 g,而沉淀质量是287 g,一般形成的沉淀多为重金属盐,可初步判定该沉淀应是NaCl形成的不溶性氯化物(一般AgCl)。
其次,要注意形成AgCl沉淀并测量时, 要先排除Ag2CO3的干扰。
(1)因此可知,第②步实验步骤是“加入用HNO3酸化的AgNO3溶液于样品溶液中,直到不再产生沉淀为止”,而第③步实验步骤是“将所得溶液过滤”。
(2)“过滤”所用的玻璃仪器有漏斗、烧杯和玻璃棒。
(3)洗涤沉淀的具体操作是向过滤器(或漏斗)中注入蒸馏水,使其浸没沉淀,待过滤完毕后,重复此操作2—3次。
(4)检验沉淀是否洗涤干净的方法是取洗涤后的滤液,加入稀盐酸,若无沉淀产生,说明沉淀已洗干净。因为AgCl沉淀表面主要附着AgNO3,所以此处是检验Ag+。
(5)计算样品中的NaCl的含量:NaCl—AgCl
w(NaCl)= ×100%=11.7%
×100%=11.7%
可知此样品合格。

 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案