题目内容
X、Y、Z、W是中学化学中常见的四种气体。已知:X、Y、Z三种气体都能对大气造成污染,在工业上都可以用碱液吸收;X是化石燃料燃烧的产物之一,是形成酸雨的物质;Y是一种单质,它的水溶液具有漂白作用;Z是硝酸工业的汽车尾气中的有害物质之一,能与水反应;W气体的水溶液滴入酚酞变红色。
请回答下列问题:
(1)X、Y两种气体按物质的量之比1:1在水溶液中能发生反应,化学方程式为 ;
(2)科学家发现,Z在催化剂条件下能与W反应生成无毒物质,化学方程式为 ;其中的氧化剂是(填化学式) 。
(3)在Z与水的反应中,氧化剂与还原剂的物质的量之比为 。
(4)检验W气体的方法是 。
请回答下列问题:
(1)X、Y两种气体按物质的量之比1:1在水溶液中能发生反应,化学方程式为 ;
(2)科学家发现,Z在催化剂条件下能与W反应生成无毒物质,化学方程式为 ;其中的氧化剂是(填化学式) 。
(3)在Z与水的反应中,氧化剂与还原剂的物质的量之比为 。
(4)检验W气体的方法是 。
(10分)(1)Cl2+SO2+2H2O=4H++2Cl-+SO42-(2分)
(2)6NO2+8NH3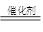 7N2+12H2O(2分) NO2(2分) (3)1:2(2分)
7N2+12H2O(2分) NO2(2分) (3)1:2(2分)
(4)将湿润的红色石蕊试纸放在集气瓶口,若试纸变蓝,证明该气体为NH3(2分)
(2)6NO2+8NH3
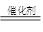 7N2+12H2O(2分) NO2(2分) (3)1:2(2分)
7N2+12H2O(2分) NO2(2分) (3)1:2(2分)(4)将湿润的红色石蕊试纸放在集气瓶口,若试纸变蓝,证明该气体为NH3(2分)
试题分析:X是化石燃料燃烧的产物之一,是形成酸雨的物质,则X是SO2。Y是一种单质,它的水溶液具有漂白作用,则Y是氯气。Z是硝酸工业的汽车尾气中的有害物质之一,能与水反应,则Z是NO2。W气体的水溶液滴入酚酞变红色,说明W是氨气。
(1)SO2和氯气两种气体按物质的量之比1:1在水溶液中能发生反应,生成硫酸和盐酸,反应的离子方程式是Cl2+SO2+2H2O=4H++2Cl-+SO42-。
(2)NO2在催化剂条件下能与氨气反应生成无毒物质,则生成物应该是氮气和水,反应的化学方程式是6NO2+8NH3
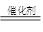 7N2+12H2O。NO2制氮元素的化合价从+4价降低到0价,得到电子,因此NO2是氧化剂。
7N2+12H2O。NO2制氮元素的化合价从+4价降低到0价,得到电子,因此NO2是氧化剂。(3)NO2溶于水的方程式是3NO2+H2O=2HNO3+NO,其中硝酸是氧化产物,NO是还原产物,所以氧化剂与还原剂的物质的量之比为1:2。
(4)氨气是一种碱性气体,检验的方法是将湿润的红色石蕊试纸放在集气瓶口,若试纸变蓝,证明该气体为NH3。2、氯气、NO2和氨气反应的有关判断、计算
点评:该题是中等难度的试题,也是高考中的常见题型,试题基础性强,难易适中。侧重考查学生的能力,有助于培养学生分析问题、解决问题的能力。

练习册系列答案
相关题目
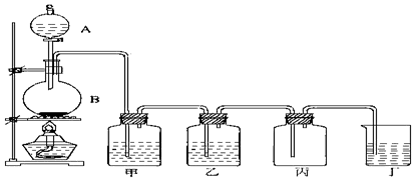
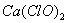
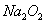

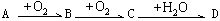 。以下推断不正确的是( )
。以下推断不正确的是( )