题目内容
将含有C、H、O的有机物3.24 mg装入元素分析装置,通入足量的O2使它完全燃烧,将生成的气体依次通过氯化钙管(A)和碱石灰管(B),测得A管质量增加了2.16 mg,B管增加了9.24 mg。已知该有机物的相对分子质量为108。
(1)燃烧此化合物3.24 mg须消耗氧气多少克?
(2)求此化合物的分子式。
(3)该化合物1分子中有1个苯环,试写出它属于酚和醇的同分异构体的结构简式和名称。
(1)8.16 mg (2)C7H8O
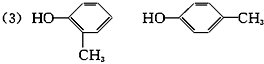
邻甲基苯酚 对甲基苯酚
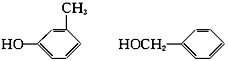
间甲基苯酚 苯甲醇
解析:
(1)根据质量守恒定律,燃烧3.24 mg该化合物消耗O2为:
2.16 mg+9.24 mg-3.24 mg=8.16 mg。
(2)2.16 mg H2O中含有H:
2.16÷18×2 mg=0.24 mg;9.24 mg CO2中含有C:
9.24÷44×12 mg=2.52 mg;
所以3.24 mg有机物中含有O:
3.24 mg-0.24 mg-2.52 mg=0.48 mg,
所以,n(C)∶n(H)∶n(O)=(2.52÷12)∶(0.24÷1)∶(0.48÷16)=7∶8∶1。
可知有机物的最简式为C7H8O,由于相对分子质量为108,所以该有机物的分子式为C7H8O。
(3)因该化合物1分子中有1个苯环,所以它属于酚和醇的同分异构体的结构简式和名称分别为:
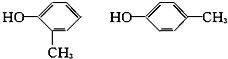
邻甲基苯酚 对甲基苯酚

间甲基苯酚 苯甲醇

练习册系列答案
 春雨教育同步作文系列答案
春雨教育同步作文系列答案
相关题目