题目内容
臭氧层是地球生命的保护伞,臭氧比氧气具有更强的氧化性。实验室可将氧气通过高压放电管来制取臭氧:3O2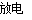 2O3
2O3
(1)若在上述反应中有30%的氧气转化为臭氧,所得混合气体的平均摩尔质量为________g/mol(写出计算过程,并将结果保留一位小数)。
(2)将8 L氧气通过放电管后,恢复到原状况,得到气体6.5 L,其中臭氧为________L。
(3)实验室将氧气和臭氧的混合气体0.896 L(标准状况)通入盛有20.0 g铜粉的反应器中,充分加热后,粉末的质量变为21.6 g。则原混合气中臭氧的体积分数为________。
(1)35.6 计算过程略(结果与过程各1分) (2)3 (3)50%
【解析】
试题分析:1)假设有1mol O2,
则 3O2 2O3
2O3
开始 1mol 0
反应 0.3mol 0.2mol
平衡 0.7mol 0.2mol
发生反应的O2为1 mol×30%=0.3 mol.
生成的O3为0.2 mol,故反应后所得气体为0.2 molO3和(1-0.3)=0.7molO2.
故M=(0.7 mol×32 g/mol+0.2 mol×48 g/mol)/(0.7 mol+0.2 mol) =35.6 g/mol
(2)此题应根据差量法计算设生成臭氧的体积为X,则:
3O2 2O3 △V
2O3 △V
3 2 1
X 8-6.5=1.5(L)
列方程式得2/x=1/1.5 解得X=3L(3)n(混合气体)=0.896/22.4=0.04(mol)
设臭氧的体积分数为a,根据氧原子守恒0.04mol×a×3+0.04mol×(1-a)×2=(21.6-20)/16mol
解得a=0.5
考点:化学方程式的有关计算

 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案