题目内容
【题目】下图是元素周期表的一部分,填写下列空格: 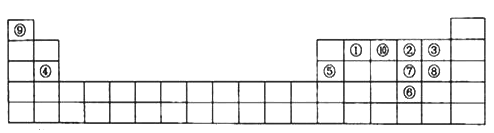
(1)在这10种元素中,非金属性最强的是_________(填化学式,下同);比较③④⑦⑧的简单离子半径由大到小依次为_________________;
(2)元素⑧的气态氢化物的电子式为_____,元素②与⑨形成的18e-化合物的电子式____;
(3)⑧的气态氢化物与⑩的气态氢化物反应的化学反应方程式___________,所得产物中含有的化学键类型有____________;
(4)比较元素⑦⑧形成的气态氢化物的稳定性:_____>_______(用化学式表示);
(5)元素⑤的氧化物与氢氧化钠溶液反应的离子方程式_______________;
(6)元素④和③形成的化合物属于________化合物,用电子式表示其形成过程__________。
【答案】 F r(S2-)>r(Cl-)>r(F-)>r(Mg2+) ![]()
![]() NH3+HCl=NH4Cl 共价键和离子键 HCl H2S Al2O3+2OH-+3H2O=2[Al(OH)4]- 离子化合物
NH3+HCl=NH4Cl 共价键和离子键 HCl H2S Al2O3+2OH-+3H2O=2[Al(OH)4]- 离子化合物 ![]()
【解析】根据元素周期表的结构和常见元素在元素周期表中位置知①为碳元素,②为氧元素,③为氟元素,④为镁元素,⑤为铝元素,⑥为硒元素,⑦为硫元素,⑧为氯元素,⑨为氢元素。
(1)同周期从左向右元素的非金属性逐渐增强,同主族由上到下元素的非金属性逐渐减弱,故在这10种元素中,非金属性最强的是F;比较③④⑦⑧的简单离子半径由大到小依次为r(S2-)>r(Cl-)>r(F-)>r(Mg2+)。
(2)HCl的电子式为![]() ,氧元素与氢元素形成的18e-化合物为H2O2,电子式为
,氧元素与氢元素形成的18e-化合物为H2O2,电子式为![]() 。
。
(3)NH3与HCl反应生成NH4Cl,化学方程式为NH3+HCl=NH4Cl ,所得产物中含有的化学键类型有离子键和共价键。
(4)非金属性:Cl>S,气态氢化物的稳定性:HCl>H2S。
(5)氧化铝与氢氧化钠溶液反应生成四羟基合铝酸钠,离子方程式为Al2O3+2OH-+3H2O=2[Al(OH)4]-。
(6)MgF2属于离子化合物,用电子式表示其形成过程为![]() 。
。