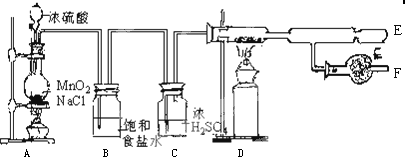
题目内容
7.1,2,3,4-四氢化萘的结构简式如图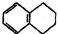 ,分子式是C10H12.常温下为无色液体,有刺激性气味,沸点207℃,不溶于水,是一种优良的溶剂,它与液溴发生反应:C10H12+4Br2→C10H8Br4+4HBr.生成的四溴化萘常温下为固态,不溶于水,有人用四氢化萘、液溴、蒸馏水和纯铁粉为原料,制备少量饱和氢溴酸溶液,实验步骤如下:
,分子式是C10H12.常温下为无色液体,有刺激性气味,沸点207℃,不溶于水,是一种优良的溶剂,它与液溴发生反应:C10H12+4Br2→C10H8Br4+4HBr.生成的四溴化萘常温下为固态,不溶于水,有人用四氢化萘、液溴、蒸馏水和纯铁粉为原料,制备少量饱和氢溴酸溶液,实验步骤如下:①按一定质量比把四氢化萘和水加入适当的容器中,加入少量纯铁粉.
②慢慢滴入液溴,不断搅拌,直到反应完全.
③取下反应容器,补充少量四氢化萘,直到溶液颜色消失.过滤,将滤液倒入分液漏斗,静置.

④分液,得到的“水层”即氢溴酸溶液.回答下列问题:
(1)如右图所示的装置,适合步骤①和②的操作的是D
(2)步骤②中如何判断“反应完全”加入的液溴颜色基本不褪
(3)步骤③中补充少量四氢化萘的目的是除出去过量的Br2
(4)步骤③中过滤后得到的固体物质是四溴化萘和铁粉.
(5)已知在实验条件下,饱和氢溴酸溶液中氢溴酸的质量分数是66%,如果溴化反应进完全,则步骤①中四氢化萘和水的质量比约是1:1.25(保留小数点后1位).
分析 本题是利用四氢化萘的性质制备饱和氢溴酸溶液的实验探究,涉及根据反应物液溴和生成物溴化氢易挥发的特点选择反应装置D进行实验,通过滴加的液溴颜色不再褪去判断反应完全,考查了反应后混合物的分离与提纯,并结合产品的质量分数计算原料的配比,建议借助原子守恒进行计算,据此判断解答;
(1)根据①②的操作及使用试剂易挥发的特点判断合理的装置;
(2)液溴是深红褐色,最初滴入到反应容器内立即参与反应而褪色,如果进行完全,滴入的液溴将仍保留在反应容器内;
(3)根据步骤②需要加入了过量的液溴进行判断;
(4)根据四溴化萘常温下为固态和加入铁粉作催化剂考虑;
(5)饱和氢溴酸水溶液中氢溴酸的质量分数是66%,可设溶液的质量为100g,则溶液里HBr的质量为66g,可计算出其物质的量,再结合反应原理可推出四氢化萘的物质的量,从而可计算出四氢化萘与水的质量比.
解答 解:(1)按照步骤①,本实验是把四氢化萘、水和铁粉加入同一容器中反应,所以B不正确.若用A中的装置进行反应,溴蒸气和刺激性气味的四氢化萘都会污染环境,同样C装置在步骤②反应时,也会造成环境污染,所以A、C都不对,故选D装置,
故答案为:D;
(2)伴随反应的进行,最初滴入的红褐色液溴立即褪色,当反应完全后,滴入的液溴颜色不再褪去,
故答案为:加入的液溴颜色基本不褪;
(3)由于步骤②加入了过量的液溴,步骤③中补充少量四氢化萘除掉剩余的溴单质,
故答案为:除出去过量的Br2;
(4)由于生成的四溴化萘常温下为固态,所以过滤后得到的固体物质是四溴化萘和铁粉,
故答案为:四溴化萘和铁粉;
(5)设溶液的质量为100g,则溶液里HBr的质量为66g,水的质量为34g,HBr的物质的量$\frac{66g}{81g/mol}$=$\frac{22}{27}$mol,根据C10H12+4Br2?C10H8Br4+4HBr可知四氢化萘的物质的量为$\frac{22}{27}$mol÷4=$\frac{11}{54}$mol,质量为$\frac{11}{54}$mol×134g/mol=$\frac{737}{27}$g,则步骤①中四氢化萘和水的质量比约是$\frac{737}{27}$g:34g≈1:1.25,
故答案为:1.25.
点评 本题考查了用四氢化萘、液溴、蒸馏水和纯铁粉为原料,制备少量饱和氢溴酸溶液,涉及了装置的选择、化学方程式的书写及配平,充分考查了学生的分析、理解能力及对所学知识掌握的熟练程度,本题难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 1mol气体的体积只有在标准状况下才约是22.4L | |
| B. | 等质量的N2和N4,在不同条件下,所含氮原子数不同 | |
| C. | 22g某气体含分子数为0.5NA,则其摩尔质量为44 | |
| D. | 标准状况下1.12L CO和N2的混合气体含有约6.02×1022个原子 |
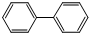 )下列有关联苯的说法中正确的是( )
)下列有关联苯的说法中正确的是( )| A. | 分子中含有6个碳碳双键 | |
| B. | 1mol联苯最多可以和6molH2发生加成反应 | |
| C. | 它可以发生加成反应、取代反应,不易被酸性高锰酸钾氧化 | |
| D. | 它和蒽(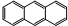 )同属于芳香烃,两者互为同系物 )同属于芳香烃,两者互为同系物 |

部分物质的有关资料如下:
| 化学式 | N2 | O2 | CO2 | NH3 | Cl2 |
| 熔点(℃) | -209.86 | -218.4 | -78.5 | -77.3 | -101 |
| 沸点(℃) | -195.8 | -183 | -33.35 | -34.6 |
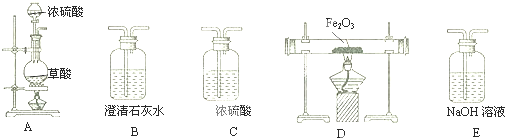
(1)试说明加入试剂前检验A、B、C处仪器气密性的操作方法先关闭分液漏斗上的活塞及关闭开关N的活塞,将M管口插入盛有水的水槽中,给A处的圆底烧瓶微热,若管口M处有气泡冒出,停止加热M处有液柱上升,证明A、B、C处的装置气密性良好.
(2)A中盛有的深色固体试剂a应是高锰酸钾,分液漏斗中的b试剂是浓盐酸.
(3)B中盛有的液体C应是饱和食盐水,C中的液体d是浓硫酸.
(4)D中发生反应的化学方程式是2HgO+2Cl2=Cl2O+HgO•HgCl2.
(5)E中的保温瓶中盛有液态致冷剂c,它应是液态空气(在“干冰”、“冰水”、“液态空气”、“液氨”、“液氯”中选择一种).在E的内管得到的Cl2O中可能含有的杂质主要是液氯.
(6)装置A、B、C间的连接方式与D、E间的连接方式有明显的差别,这区别是A、B、C间用乳胶管连接,D、E间不能乳胶管连接,用这种不同的连接方式的主要理由是Cl2O遇有机物易爆炸.
 溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:按下列合成步骤回答问题:
溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:按下列合成步骤回答问题:| 苯 | 溴 | 溴苯 | |
| 密度/g•cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 水中溶解度 | 微溶 | 微溶 | 微溶 |
在b中小心加入4.0mL液态溴.向a中滴入几滴溴,有白色雾产生,是因为生成了HBr气体.继续滴加至液溴滴完.装置d的作用是吸收HBr和Br2;制取溴苯的化学方程式C6H6+Br2$\stackrel{FeBr_{3}}{→}$C6H5Br+HBr.该反应的催化剂为FeBr3.
(2)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10mL水,然后过滤除去未反应的铁屑;
②滤液依次用10mL水、8mL10%的NaOH溶液、10mL水洗涤.NaOH溶液洗涤的作用是:除去HBr和未反应的Br2.
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤.加入氯化钙的目的是作干燥剂;
(3)经以上分离操作后,粗溴苯中还含有的主要杂质为苯,要进一步提纯,下列操作中必须的是C(填入正确选项前的字母);
A.重结晶 B.过滤 C.蒸馏 D.萃取
(4)在该实验中,a的容积最适合的是B(填入正确选项前的字母).
A.25mL B.50mL C.250mL D.500mL
(5)取反应后烧杯中的溶液2ml加入足量的稀硝酸酸化,再滴入AgNO3溶液,有浅黄色沉淀生成,不能(能或不能)证明苯与液溴反生了取代反应,为什么?挥发出来的溴进入烧杯中与水反应生成的溴离子与硝酸银溶液发生反应,生成淡黄色沉淀.
| A. | 将水加热,平衡向正向移动,Kw不变 | |
| B. | 向水中加入少量NaOH固体,水电离的c(OH-)增大 | |
| C. | 向水中加入少量CH3COONa固体,平衡向正向移动,Kw增大 | |
| D. | 向水中加入少量NaHSO4固体,水的电离平衡向逆向移动,c(H+)增大 |