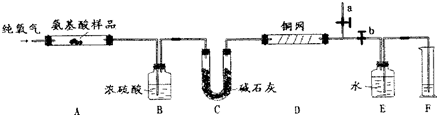
题目内容
17.原电池中,正极是( )| A. | 发生氧化反应的电极 | |
| B. | 电子流出的电极 | |
| C. | 发生还原反应的电极 | |
| D. | 与负极相比较,金属性较活泼的一极 |
分析 原电池中,与负极相比较,金属性较不活泼的为正极,得电子发生还原反应,电子由负极经外电路流向正极,据此分析.
解答 解:原电池中,与负极相比较,金属性较不活泼的为正极,得电子发生还原反应,电子由负极经外电路流向正极,所以为电子流进的电极,故ABD错误,C正确;
故选C.
点评 本题考查原电池知识,侧重于学生的分析能力和基本概念的考查,为高频考点,有利于培养学生的良好科学元素,提高学习的积极性,难度不大,注意把握原电池的工作原理.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
8.在实验室中从苯酚中分离出苯,可选用下列装置中的( )
| A. | 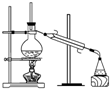 | B. |  | C. | 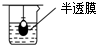 | D. | 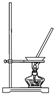 |
5.下列化学式所表示的化合物中,具有两种或两种以上同分异构体的有( )
| A. | CH2O2 | B. | CH2Cl2 | C. | C7H8O | D. | C2H5NO2 |
12.为了除去下列各组混合物中括号内的物质,所选用的试剂与主要分离方法都正确的是( )
| 混合物 | 试剂 | 分离方法 | |
| A | 苯(苯酚) | 浓溴水 | 过滤 |
| B | 碘水(水) | 花生油 | 萃取 |
| C | 乙酸乙酯(乙酸) | 饱和Na2CO3溶液 | 分液 |
| D | 鸡蛋清溶液(氯化钠溶液) | 蒸馏水 | 渗析 |
| A. | A | B. | B | C. | C | D. | D |
2.下列各组物质中,其互称为同分异构体的是( )
| A. | 12C、13C和14C | B. | O2和O3 | ||
| C. | CH3CH2CH2CH3和CH3CH (CH3)CH3 | D. | CH3CH2CH3和CH3CH2CH2CH3 |
9.工业上由氯气与消石灰反应制备漂粉精,其化学式可以用xCa(ClO)2•yCaCl2•zCa(OH)2(x、y、z为简单整数)来表示.某兴趣小组同学对漂粉精进行定性、定量探究如下:
Ⅰ.证明漂粉精中含有CaCl2
①向漂粉精固体中滴加足量浓硫酸,观察到黄绿色气体生成.写出生成黄绿色气体的化学反应方程式:Ca(ClO)2+CaCl2+4H2SO4(浓)=2Ca(HSO4)2+2Cl2↑+2H2O
(或Ca(ClO)2+CaCl2+2H2SO4(浓)=CaSO4+2Cl2↑+2H2O).
②将生成的黄绿色气体缓缓通过足量碱石灰,碱石灰增重,并收集到无色气体.推测生成气体中除Cl2,还含有HCl、O2(填化学式).
Ⅱ.证明漂粉精中含有Ca(OH)2[已知电离常数:Ka1(H2CO3)>Ka(HClO)>Ka2(H2CO3)]
①将少量漂粉精溶于水后,测定其pH值为12.3.采用的测定方法可能是c(选填答案编号).
a.使用广泛pH试纸 b.使用精密pH试纸c.使用pH计 d.以酚酞为指示剂进行酸碱中和滴定
②下列探究步骤的设计中,对证明该结论无意义的是a(选填答案编号).
a.向漂粉精溶液中通入适量CO2,测定溶液的pH值变化
b.向漂粉精溶液中加入适量碳酸氢钠固体,测定溶液pH值变化
c.向漂粉精溶液中加入适量亚硫酸钠固体,测定溶液pH值变化 ③
Ⅲ.测定漂粉精中有效成分的含量
【实验原理】ClO-+2I-+2H+=Cl-+I2+H2O; I2+2S2O32-=2I-+S4O62-
【实验步骤】
i.称取7.740g漂粉精固体,溶解,配成250mL溶液;
ii.量取该溶液5.00mL于锥形瓶,加入过量KI溶液、酸化,并加入指示剂;
iii.用0.100mol/L Na2S2O3标准溶液滴定至终点,记录始末读数;
iv.重复ii、iii操作,记录始末读数.
①该实验中要使用的定量仪器除电子天平外还有滴定管、250mL容量瓶(写名称).
②步骤ii中加入的指示剂为淀粉(写名称),当观察到溶液由蓝色变为无色,且半分钟内不变化
时,达到滴定终点.
③实验数据如下:
若理论上滴定时消耗标准溶液27.00mL,则相对误差为-0.185%(保留3位有效数字).
④该漂粉精中Ca(ClO)2的质量分数为(以理论值计)0.624(保留3位有效数字).
Ⅰ.证明漂粉精中含有CaCl2
①向漂粉精固体中滴加足量浓硫酸,观察到黄绿色气体生成.写出生成黄绿色气体的化学反应方程式:Ca(ClO)2+CaCl2+4H2SO4(浓)=2Ca(HSO4)2+2Cl2↑+2H2O
(或Ca(ClO)2+CaCl2+2H2SO4(浓)=CaSO4+2Cl2↑+2H2O).
②将生成的黄绿色气体缓缓通过足量碱石灰,碱石灰增重,并收集到无色气体.推测生成气体中除Cl2,还含有HCl、O2(填化学式).
Ⅱ.证明漂粉精中含有Ca(OH)2[已知电离常数:Ka1(H2CO3)>Ka(HClO)>Ka2(H2CO3)]
①将少量漂粉精溶于水后,测定其pH值为12.3.采用的测定方法可能是c(选填答案编号).
a.使用广泛pH试纸 b.使用精密pH试纸c.使用pH计 d.以酚酞为指示剂进行酸碱中和滴定
②下列探究步骤的设计中,对证明该结论无意义的是a(选填答案编号).
a.向漂粉精溶液中通入适量CO2,测定溶液的pH值变化
b.向漂粉精溶液中加入适量碳酸氢钠固体,测定溶液pH值变化
c.向漂粉精溶液中加入适量亚硫酸钠固体,测定溶液pH值变化 ③
Ⅲ.测定漂粉精中有效成分的含量
【实验原理】ClO-+2I-+2H+=Cl-+I2+H2O; I2+2S2O32-=2I-+S4O62-
【实验步骤】
i.称取7.740g漂粉精固体,溶解,配成250mL溶液;
ii.量取该溶液5.00mL于锥形瓶,加入过量KI溶液、酸化,并加入指示剂;
iii.用0.100mol/L Na2S2O3标准溶液滴定至终点,记录始末读数;
iv.重复ii、iii操作,记录始末读数.
①该实验中要使用的定量仪器除电子天平外还有滴定管、250mL容量瓶(写名称).
②步骤ii中加入的指示剂为淀粉(写名称),当观察到溶液由蓝色变为无色,且半分钟内不变化
时,达到滴定终点.
③实验数据如下:
| 实验编号 | 1 | 2 | 3 |
| 消耗Na2S2O3体积/mL | 26.90 | 27.00 | 26.95 |
④该漂粉精中Ca(ClO)2的质量分数为(以理论值计)0.624(保留3位有效数字).
6.今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH${\;}_{4}^{+}$、Ca2+、Cl-、CO32-、SO42-,现取三份100mL溶液进行如下实验:
Ⅰ.向第一份溶液中加入AgNO3溶液,有沉淀产生;
Ⅱ.向第二份溶液中加入足量NaOH溶液后加热,收集到气体0.04mol;
Ⅲ.向第三份溶液中加入足量BaCl2溶液,得到沉淀6.27g,经足量盐酸洗涤后,剩余沉淀质量为2.33g.根据上述实验中,以下推测正确的是( )
Ⅰ.向第一份溶液中加入AgNO3溶液,有沉淀产生;
Ⅱ.向第二份溶液中加入足量NaOH溶液后加热,收集到气体0.04mol;
Ⅲ.向第三份溶液中加入足量BaCl2溶液,得到沉淀6.27g,经足量盐酸洗涤后,剩余沉淀质量为2.33g.根据上述实验中,以下推测正确的是( )
| A. | K+一定存在,且c(K+)≥0.2mol•L-1 | B. | 100mL溶液中含CO32-0.01mol | ||
| C. | K+不一定存在 | D. | Cl-一定存在 |
7.等质量的下列烃完全燃烧,需要氧气最多的是( )
| A. | 甲烷 | B. | 乙烷 | C. | 丙烯 | D. | 苯 |