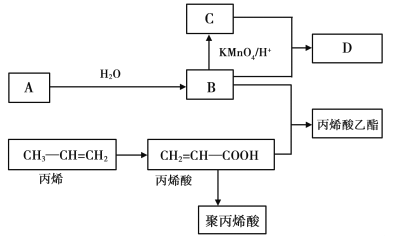
题目内容
【题目】已知X、Y和Z三种元素的原子序数之和等于42.X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子.X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子.请回答下列问题:
(1)X元素的符号是 ;
(2)Y元素原子的价层电子的轨道表示式为![]() ,该元素的名称是 ;
,该元素的名称是 ;
(3)X与Z可形成化合物XZ3,该化合物的空间构型为 ;
(4)比较X的氢化物与同族第二、第三周期元素所形成的氢化物稳定性、沸点高低并说明理由 .
【答案】(1)As;
(2)![]() ;氧;
;氧;
(3)三角锥形;
(4)沸点:NH3>AsH3>PH3,氨气分子之间存在氢键,沸点最高,AsH3的相对分子质量比PH3的大,AsH3中分子间作用力更强,AsH3的沸点高于PH3;
稳定性:NH3>PH3>AsH3;键长N﹣H<P﹣H<As﹣H,键长越短,键能越大,化合物稳定.
【解析】试题分析:X元素原子的4p轨道上有3个未成对电子,X元素原子的核外电子排布式为 1s22s22p63s23p63d104s24p3,处于第四周期第ⅤA族,故X为As元素;Y元素原子的最外层2p轨道上有2个未成对电子,Y的2p轨道上有2个电子或4个电子,所以Y为碳元素或氧元素,X跟Y可形成化合物X2Y3,故Y为氧元素;X、Y和Z三种元素的原子序数之和等于42,则Z的质子数为42﹣8﹣33=1,则Z为氢元素,氢原子可以形成负一价离子,符合题意.
解:X元素原子的4p轨道上有3个未成对电子,X元素原子的核外电子排布式为 1s22s22p63s23p63d104s24p3,处于第四周期第ⅤA族,故X为As元素;Y元素原子的最外层2p轨道上有2个未成对电子,Y的2p轨道上有2个电子或4个电子,所以Y为碳元素或氧元素,X跟Y可形成化合物X2Y3,故Y为氧元素;X、Y和Z三种元素的原子序数之和等于42,则Z的质子数为42﹣8﹣33=1,则Z为氢元素,氢原子可以形成负一价离子,符合题意.
(1)由上述分析可知,X为As,故答案为:As;
(2)Y为氧元素,原子核外电子排布式为 1s22s22p4,价层电子的轨道表示式为![]() ,
,
故答案为:![]() ;氧;
;氧;
(3)X与Z可形成化合物XZ3为AsH3,该化合物与氨气分子空间构型相似,其空间构型为三角锥形,故答案为:三角锥形;
(4)氨气分子之间存在氢键,沸点最高,AsH3的相对分子质量比PH3的大,AsH3中分子间作用力更强,AsH3的沸点高于PH3,故沸点:NH3>AsH3>PH3;
AsH3与NH3、PH3中,键长N﹣H<P﹣H<As﹣H,键长越短,键能越大,化合物稳定,所以稳定性NH3>PH3>AsH3.
故答案为:沸点:NH3>AsH3>PH3,氨气分子之间存在氢键,沸点最高,AsH3的相对分子质量比PH3的大,AsH3中分子间作用力更强,AsH3的沸点高于PH3;
稳定性:NH3>PH3>AsH3;键长N﹣H<P﹣H<As﹣H,键长越短,键能越大,化合物稳定.