题目内容
(10分)下表是部分短周期元素的原子半径及主要化合价:
试回答下列问题:
(1)五种元素中原子半径最大的元素在周期表中位置是 。
(2)Y的氢化物比Q的氢化物沸点高的原因是 。
(3)X或与R按1∶1的原子个数比形成化合物甲,甲中存在的化学键有 ;X可与W组成含18e-的化合物乙,则乙的电子式为 ;X可与Z组成一种有恶臭味的气体丙,丙分子中各原子最外层均满足8e-结构,且含有非极性键。1 mol
丙气体可与2 mol氧气完全反应,生成一种气体,且反应前后气体的总体积不变,该生成物能使澄清石灰水变浑浊,请写出丙分子的结构式 。
| 元素代号 | W | R | X | Y | Z | Q |
| 原子半径/nm | 0.037 | 0.186 | 0.074 | 0.075 | 0.077 | 0.110 |
| 主要化合价 | +1 | +1 | -2 | -3,+5 | +2、+4 | -3、+5 |
(1)五种元素中原子半径最大的元素在周期表中位置是 。
(2)Y的氢化物比Q的氢化物沸点高的原因是 。
(3)X或与R按1∶1的原子个数比形成化合物甲,甲中存在的化学键有 ;X可与W组成含18e-的化合物乙,则乙的电子式为 ;X可与Z组成一种有恶臭味的气体丙,丙分子中各原子最外层均满足8e-结构,且含有非极性键。1 mol
丙气体可与2 mol氧气完全反应,生成一种气体,且反应前后气体的总体积不变,该生成物能使澄清石灰水变浑浊,请写出丙分子的结构式 。
(1)第三周期IA族 (2)NH3的分子间存在氢键

 (3)离子,非极性键(或离子键,共价键);H∶O∶O∶H;O=C=C=C=0
(3)离子,非极性键(或离子键,共价键);H∶O∶O∶H;O=C=C=C=0

 (3)离子,非极性键(或离子键,共价键);H∶O∶O∶H;O=C=C=C=0
(3)离子,非极性键(或离子键,共价键);H∶O∶O∶H;O=C=C=C=0略

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
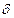 键。在H-Y,H-Z两种共价键中,键的极性较强的是 ,键长较长的是 。
键。在H-Y,H-Z两种共价键中,键的极性较强的是 ,键长较长的是 。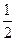 O2(g)=XO2(g) △H=" " -283.0kJ.mol-1
O2(g)=XO2(g) △H=" " -283.0kJ.mol-1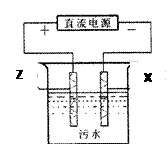
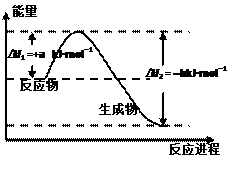

 A.如果A是金属元素,则B可能是稀有元素
A.如果A是金属元素,则B可能是稀有元素