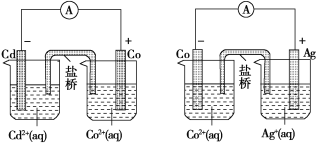
题目内容
【题目】容积均为2L的甲乙丙三个恒容密闭容器中均加入0.10mol/L的N2、0.26mol/L的H2 , 进行合成氨反应:N2(g)+3H2(g)2NH3(g)△H=﹣92.4kJ/mol.图1表示不同反应条件下N2的浓度随时间的变化,图2表示其它条件相同,温度分别为T1、T2、T3且恒定不变,达到平衡时NH3的质量分数.下列判断不正确的是( ) 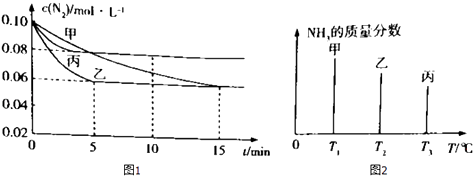
A.图2 中反应速率最快的是容器丙
B.图1 中容器乙的反应可能使用了催化剂
C.图1 中容器乙0~5 min时间内v ![]() =0.012mol/(L?min)
=0.012mol/(L?min)
D.图1 中容器丙内反应的平衡常数为2.5
【答案】C
【解析】解:A.温度越高,反应速率越快,由图2可知,丙中温度最高,反应速率最快,故A正确;B.由图1可知,甲、乙的平衡浓度相同,但乙中时间短,图1 中容器乙的反应可能使用了催化剂,故B正确;
C.图l 中容器乙0~5 min时间内v ![]() =
= ![]() =0.008mol/(Lmin),故C错误;
=0.008mol/(Lmin),故C错误;
D.由图1可知,氮气开始的浓度为0.1mol/L,平衡浓度为0.08mol/L,则
N2(g)+ | 3H2(g) | 2NH3(g) | ||
开始 | 0.1 | 0.26 | 0 | |
转化 | 0.02 | 0.06 | 0.04 | |
平衡 | 0.08 | 0.2 | 0.04 |
K= ![]() =2.5,故D正确;
=2.5,故D正确;
故选C.
【考点精析】解答此题的关键在于理解化学平衡的计算的相关知识,掌握反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%.

练习册系列答案
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案
相关题目