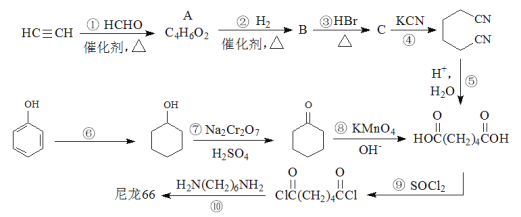
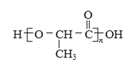
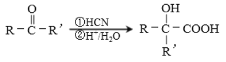
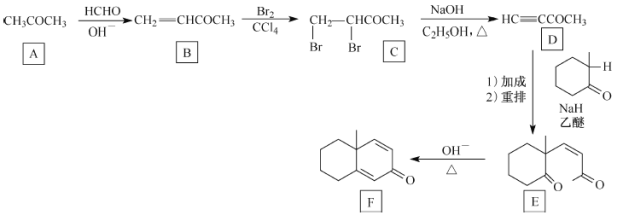
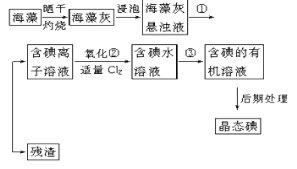
��Ŀ����
����Ŀ�����������(Na2S2O3)�㷺���ڵ�ơ�����Ƥ���֯ƷƯ������ȼ��ȡ�ijʵ��С���ͬѧ��Na2S��SO2Ϊԭ���Ʊ�Na2S2O3���ش��������⣺
(1)�Ʊ�Na2S��Һ
��Na2S��Һ�ʼ��ԣ�ԭ����____________________________(�����ӷ���ʽ��ʾ)��
�ڹ�ҵƷ�����г���������Na2SO4��Na2CO3������д��������ǽ���������ˮ��Ȼ�����������_____________(�ѧʽ)��Һ��ֽ��貢���ˣ��پ��Ƶ�Na2S��Һ��
(2)������ͼװ���Ʊ�Na2S2O3
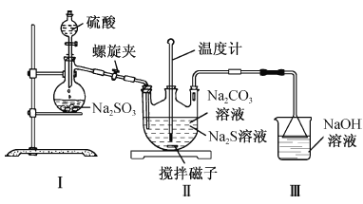
��װ�â��з�Ӧ�Ļ�ѧ����ʽΪ___________________________________��
��ʵ������д������в��������������ʵ���λ�ã�һ����ʹ��Ӧ������SO2����Ͼ��ȵ�ͨ��Na2S��Na2CO3��Һ�У���һ�����������______________________________��
��������ƿ������Na2S2O3�Ļ�ѧ����ʽΪ��____________________________________��װ�â��������_________________________________________________��
���𰸡�S2- +H2O ![]() HS- +OH- BaS[��Ba(OH)2] Na2SO3 + H2SO4 = Na2SO4 + H2O +SO2�� ��ֹ�������� 2Na2S+Na2CO3+4SO2 = 3Na2S2O3+CO2 ����SO2��CO2���������岢��ֹ����
HS- +OH- BaS[��Ba(OH)2] Na2SO3 + H2SO4 = Na2SO4 + H2O +SO2�� ��ֹ�������� 2Na2S+Na2CO3+4SO2 = 3Na2S2O3+CO2 ����SO2��CO2���������岢��ֹ����
��������
(1)��Na2S��ǿ�������Σ���Һ��S2-��ˮ�⣻
�ڽ���Һ�е�SO42-��CO32-ת��Ϊ������ͬʱ�������µ����ʣ�
(2)��װ�â���������Na2SO3��Һ��Ӧ���������ƺ�SO2���壻
�������ܽ���Һ��ʱҪ��������
��������ƿ��SO2����ͨ��Na2S��Na2CO3��Һ�У�����Na2S2O3��CO2���壻SO2�����ж��������ŷŵ������С�
(1)��Na2S��ǿ�������Σ���Һ��S2-��ˮ����һ��ˮ��Ϊ��������ˮ�ⷴӦ�����ӷ���ʽΪS2- +H2O![]() HS- +OH-��
HS- +OH-��
�������г���������Na2SO4��Na2CO3������������ˮ��Ȼ��μ�������BaS[��Ba(OH)2]��Һ������Һ�е�SO42-��CO32-ת��ΪBaSO4��BaCO3�����������˼���Na2S��Һ��
(2)��װ�â���������Na2SO3��Һ��Ӧ���������ƺ�SO2���壬������Ӧ�Ļ�ѧ����ʽΪNa2SO3 + H2SO4 = Na2SO4 + H2O +SO2����
��ʵ�������ͨ���������в��������������ʵ���λ�ã���ʹ��Ӧ������SO2����Ͼ��ȵ�ͨ��Na2S��Na2CO3��Һ�У����������������ã�
��������ƿ��SO2����ͨ��Na2S��Na2CO3��Һ�У�����Na2S2O3��CO2���壬������Ӧ�Ļ�ѧ����ʽΪ2Na2S+Na2CO3+4SO2 = 3Na2S2O3+CO2��SO2�����ж�����NaOH��Һ���պ���CO2��SO2��β�����ɷ���Ⱦ������ͬʱʹ�õ��õ�����©���ɷ�������

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ��������������C9H10O2������ˮ����ζ������������ˮ�㾫�����쾫�ͣ���������ʳƷ��ҵ�У�Ҳ�������л��ϳ��м��塢�ܼ��ȣ����Ʊ�����Ϊ��
![]() +C2H5OH
+C2H5OH![]()
![]() +H2O
+H2O
��֪��
��ɫ��״̬ | �е㣨�棩 | �ܶȣ�gcm��3�� | |
������* | ��ɫƬ״���� | 249 | 1.2659 |
���������� | ��ɫ����Һ�� | 212.6 | 1.05 |
�Ҵ� | ��ɫ����Һ�� | 78.3 | 0.7893 |
������ | ��ɫ����Һ�� | 80.8 | 0.7318 |
*��������100���Ѹ��������ʵ�鲽�����£�
����Բ����ƿ�м���12.20g�����ᡢ25mL�Ҵ�����������20mL�����飬�Լ�4mLŨ���ᣬ��Ͼ��Ȳ������ʯ������ͼ��ʾװ�������������¶���6570����Ȼ���2h����Ӧʱ������һ�Ҵ���ˮ���γɡ���������е�62.6�棩��������������÷�ˮ�����Ϸ����ȥ��Ӧ���ɵ�ˮ��������������Ҵ���
�ڷ�Ӧ�������������ų���ˮ����Һ��ر��������������ȣ�����ˮ�����ռ�����Һ�岻���������ӣ�ֹͣ���ȣ�
�۽���ƿ�ڷ�ӦҺ����ʢ������ˮ���ձ��У���������Na2CO3����Һ�����ԣ�
���÷�Һ©���ֳ��л��㣬ˮ����25mL������ȡ��Һ��Ȼ��ϲ����л��㣮�����Ȼ��ƣ��Դֲ����������װ����ͼ��ʾ���������������Ѻ������£�����210213�����֣�
�ݼ���ϸ�ò�Ʒ���Ϊ13.16mL��
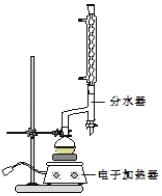
��1���ڸ�ʵ���У�Բ����ƿ���ݻ����ʺϵ���_____��������ȷѡ��ǰ����ĸ����
A.25mL B.50mL C.100mL D.250mL
��2��������з�ʯ��������____��ʹ�÷�ˮ�����Ϸ����ȥˮ��Ŀ����_____��
��3�������Ӧ������ֵ��¶���__��
A.215220�� B.8590�� C.7880�� D.6570��
��4������ۼ���Na2CO3��������________����Na2CO3���벻�㣬��֮������ʱ��������ƿ�пɼ����������ɣ������������ԭ����________��
��5�����ڲ�����е���ȡ��Һ����������ȷ����____��
A��ˮ��Һ�м������ѣ�ת������Һ©���У����ϲ���������Һ©����ת������������ҡ
B����ҡ���κ����Һ©���¿ڵIJ���������
C����������ҡ���������ֳַ�Һ©�����ô�Һ��ֲ�
D���ų�Һ��ʱ��Ӧ���Ͽڲ������������ϵİ��۶�©�����ϵ�С��
��6�����㱾ʵ��IJ���Ϊ____��
����Ŀ��(1)һ�������£�CO2��1.0mol��L-1NaOH��Һ��ַ�Ӧ�ų����������±���
��Ӧ��� | CO2�����ʵ���/mol | NaOH��Һ�����/L | �ų�������/kJ |
1 | 0.5 | 0.75 | X |
2 | 1.0 | 2.00 | y |
��������CO2��NaOH��Һ��Ӧ����NaHCO3���Ȼ�ѧ����ʽΪ_____________________��
(2)�ý�̿��ԭNO�ķ�ӦΪ��2NO(g)+C(s)![]() N2(g)+CO2(g)�����ݻ���Ϊ1L�ļס��ҡ����������������зֱ���������Ľ�̿��һ������NO����ø�������n(NO)�淴Ӧʱ��t�ı仯������±���
N2(g)+CO2(g)�����ݻ���Ϊ1L�ļס��ҡ����������������зֱ���������Ľ�̿��һ������NO����ø�������n(NO)�淴Ӧʱ��t�ı仯������±���
�¶� t/min | 0 | 40 | 80 | 120 | 160 |
��(673K) | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
��(T) | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
��(673K) | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
�ټ������У�0��40min����NO��Ũ�ȱ仯��ʾ��ƽ����Ӧ����v(NO)=____________��
�ڸ÷�Ӧ�ġ�H__________(�����)
a������0 b��С��0 c������0 d������ȷ��
�۱������ﵽƽ��ʱ��NO��ת����Ϊ__________________��
(3)298Kʱ��NH3��H2O�ĵ��볣��Kb=2��10-5��H2CO3�ĵ��볣��Kal=4��10-7��Ka2=4��10-11����NH4HCO3��Һ�У�c(NH4+)__________c(HCO3-)(����>������<������=��)����ӦNH4++HCO3-+H2O![]() NH3��H2O+H2CO3��ƽ�ⳣ��K����ֵ(�ÿ�ѧ��������ʾ)Ϊ_____��
NH3��H2O+H2CO3��ƽ�ⳣ��K����ֵ(�ÿ�ѧ��������ʾ)Ϊ_____��