题目内容
【题目】在密闭容器中进行反应CH4(g)+H2O(g)CO(g)+3H2(g)△H>0,测得c(CH4)随反应时间(t)的变化如图所示.下列判断正确的是( ) 
A.10min时,改变的外界条件可能是升高温度
B.0~5min内,v(H2)=0.1mol/(Lmin)
C.恒温下,缩小容器体积,平衡后c(H2)减小
D.12min时,反应达平衡的本质原因是气体总质量不再变化
【答案】A
【解析】解:A.由图可知,10min时甲烷的浓度继续减小,该反应向正反应方向移动,该反应正反应是吸热反应,可能是升高温度,故A正确;
B.根据图可知,前5min内甲烷的浓度由1.00mol/L减小为0.50mol/L,故c(CH4)= ![]() =0.1mol/(Lmin),由化学计量数之比等于反应速率之比,则v(H2)=3×0.1mol/(Lmin)=0.3mol/(Lmin),故B错误;
=0.1mol/(Lmin),由化学计量数之比等于反应速率之比,则v(H2)=3×0.1mol/(Lmin)=0.3mol/(Lmin),故B错误;
C.恒温下,缩小容器体积,压强增大,平衡向逆反应方向移动,移动的结果降低氢气浓度的增大,但不会消除浓度增大,平衡后c(H2)增大,故C错误;
D.反应达平衡的本质是正、逆速率相等,故D错误;
故选A.

【题目】丙酮(C3H6O)通常是无色液体,易溶于水,密度小于1 g·mL-1,沸点约为55℃。要从水与丙酮的混合物中将丙酮分离出来,下列最为合理的是( )
A. 蒸馏 B. 分液 C. 过滤 D. 蒸发
【题目】车辆排放的氮氧化物、煤燃烧产生的二氧化硫是导致雾霾天气的“罪魁祸首”.活性炭可处理大气污染物NO.在5L密闭容器中加入NO和活性炭(假设无杂质),一定条件下生成气体E和F.当温度分别在T1和T2时,测得各物质平衡时物质的量(n/mol)如表:
物质 | 活性炭 | NO | E | F |
初始 | 3.000 | 0.10 | 0 | 0 |
T1 | 2.960 | 0.020 | 0.040 | 0.040 |
T2 | 2.975 | 0.050 | 0.025 | 0.025 |
(1)写出NO与活性炭反应的化学方程式;
(2)计算上述反应T1℃时的平衡常数K1=;
(3)上述反应T1℃时达到化学平衡后再通入0.1molNO气体,则达到新化学平衡时NO的转化率为;
(4)如图为在T1℃达到平衡后在t2、t3、t4、t5时改变某一个反应条件,平衡体系中反应速率随时间变化的情况,且所改变的条件均不同.已知t3﹣t4阶段为使用催化剂.请判断该反应△H0(填“>”或“<”). 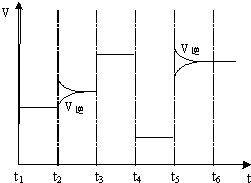
【题目】在某温度下2L密闭容器中,3种气体加入起始状态和平衡状态时的物质的量(n)如下表所示:
X | Y | W | |
起始状态(mol) | 2 | 1 | 0 |
平衡状态(mol) | 1 | 0.5 | 1.5 |
下列有关说法正确的是( )
A.该温度下,该反应的平衡常数K=9
B.升高温度,若W的体积分数减小,此反应△H>0
C.该温度下,该反应的方程式为 2X(g)+Y(g)3W(g)
D.增大压强,正、逆反应速率都增大,平衡向正反应方向移动