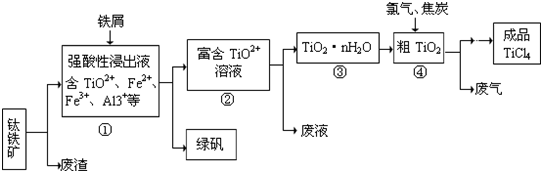
题目内容
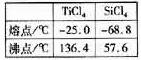
四氯化钛(TiCl4)是工业上制备金属钛的重要原料。常温下,它是一种极易水解的无色液体,沸点为136.4℃。工业制备TiCl4和钛的反应分布为:
TiO2 +2C+2Cl2![]() TiCl4 +2CO ;TiCl4 +2Mg
TiCl4 +2CO ;TiCl4 +2Mg Ti + 2MgCl2
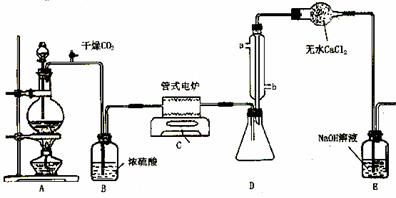
下图是实验室制备TiCl4的反应装置,主要操作步骤:
①连接好整套装置,在通Cl2前先通入CO2气体并持续一段时间;
②当锥形瓶中TiCl4的量不再增加时,停止加热,从侧管中改通CO2气体直到电炉中的瓷管冷却为止;
③将TiO2、炭粉混合均匀后,装入管式电炉中;
④ 将电炉升温到800℃,一段时间后改通Cl2,同时在冷凝管中通冷凝水。
试回答下列问题:
⑴.正确的操作顺序为(填序号)___________________________。
⑵.装置A中的反应的离子方程式为__________________________。
⑶.操作①的目的是_________________________________。
⑷.装置D中冷凝管进水口的位置是(填a或b)_________,
装置E的作用是___________________________________________________。
⑸.TiCl4露置于空气中极易水解,其化学方程式可表示为_____________________。
⑹.工业上常用金属镁在800℃高温和氩气氛围中还原TiCl4的方法制备钛,
![]() ,氩气的作用为_____________________________.
,氩气的作用为_____________________________.
(1)③①④②
(2) MnO2+4H+ +2 Cl-![]() Mn2+ + Cl2↑+2H2O
Mn2+ + Cl2↑+2H2O
(3)排尽装置内的空气,避免TiCl4 遇空气中水蒸气发生水解
(4) b_; 吸收多余的Cl2,以免污染空气
(5)TiCl4 + 4H2O = 4HCl + Ti(OH)4
(6)防止Mg和Ti被空气中氧气氧化分解