题目内容
小苏打、胃舒平、达喜都是常用的中和胃酸的药物。
(1)小苏打每片含0.50gNaHCO3,2片小苏打片和胃酸完全中和,被中和的H+是 mol
(2)胃舒平每片含0.245gAl(OH)3.中和胃酸时,6片小苏打相当于胃舒平 片
(3)达喜的化学成分是铝和镁的碱式盐:
取该碱式盐3.01g,加入2.0mol/L盐酸使其溶解,当加入盐酸42.5mL时开始产生CO2,加入盐酸至45.0mL时正好完全反应,计算该碱式盐样品中氢氧根与碳酸根的物质的量之比
(1)小苏打每片含0.50gNaHCO3,2片小苏打片和胃酸完全中和,被中和的H+是 mol
(2)胃舒平每片含0.245gAl(OH)3.中和胃酸时,6片小苏打相当于胃舒平 片
(3)达喜的化学成分是铝和镁的碱式盐:
取该碱式盐3.01g,加入2.0mol/L盐酸使其溶解,当加入盐酸42.5mL时开始产生CO2,加入盐酸至45.0mL时正好完全反应,计算该碱式盐样品中氢氧根与碳酸根的物质的量之比
(1)0.012mol (2)3.8 (3)16:1
(1)2片小苏打片中含有碳酸氢钠是1.0g,所以根据方程式HCO3-+H+=H2O+CO2↑可知,被中和的氢离子是2×0.5/(23+1+12+16×3)=0.012mol。
(2)6片小苏打能中和氢离子是0.012mol×3=0.036mol,则根据方程式Al(OH)3+3H+=Al3++3H2O可知,消耗氢氧化铝是0.012mol,质量是0.012mol×78g/mol=0.936g,所以0.936÷0.245=3.8。
(3)42.5mL和45.0mL盐酸的物质的量分别是0.085mol和0.09mol,则根据方程式OH-+H+=H2O、H++CO32-=HCO3-、HCO3-+H+=H2O+CO2↑可知,HCO3-的物质的量是0.005mol,则与CO32-反应的氢离子是0.005mol,所以和OH-反应的氢离子是0.08mol,碱式盐样品中氢氧根与碳酸根的物质的量之比0.08︰0.005=16︰1。
(2)6片小苏打能中和氢离子是0.012mol×3=0.036mol,则根据方程式Al(OH)3+3H+=Al3++3H2O可知,消耗氢氧化铝是0.012mol,质量是0.012mol×78g/mol=0.936g,所以0.936÷0.245=3.8。
(3)42.5mL和45.0mL盐酸的物质的量分别是0.085mol和0.09mol,则根据方程式OH-+H+=H2O、H++CO32-=HCO3-、HCO3-+H+=H2O+CO2↑可知,HCO3-的物质的量是0.005mol,则与CO32-反应的氢离子是0.005mol,所以和OH-反应的氢离子是0.08mol,碱式盐样品中氢氧根与碳酸根的物质的量之比0.08︰0.005=16︰1。

练习册系列答案
相关题目

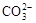 和HCO—3总数为0.1 NA
和HCO—3总数为0.1 NA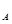 表示阿伏加德罗常数的值。下列叙述正确的是( )
表示阿伏加德罗常数的值。下列叙述正确的是( ) 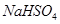 晶体中阳离子和阴离子的总数为0.03 N
晶体中阳离子和阴离子的总数为0.03 N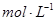 硫酸与足量铜反应,生成
硫酸与足量铜反应,生成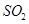 的分子数为0.92 N
的分子数为0.92 N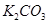 溶液中离子总数小于3N
溶液中离子总数小于3N