题目内容
【题目】金属钛性能优越,被誉为继 Fe、Al 后应用广泛的“第三金属”。
(1)Ti 基态原子的价层电子排布图为_____。
(2)钛能与 B、C、N、O 等非金属元素形成稳定的化合物。电负性C_____(填“>”或“<”,下同) B;第一电离能:N_O,原因是_________。
(3)月球岩石——玄武岩的主要成分为钛酸亚铁(FeTiO3)。FeTiO3 与 80%的硫酸反应可生成TiOSO4。SO42-的空间构型为_____形,其中硫原子采用______杂化,写出 SO42- 的一种等电子体的化学式________。
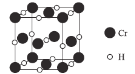
(4)Ti 的氧化物和 CaO 相互作用能形成钛酸盐 CaTiO3,CaTiO3 的晶体结构如图 1 所示,(Ti4+位于立方体的顶点)。该晶体中,Ti4+和周围 _______个 O2-相紧邻。
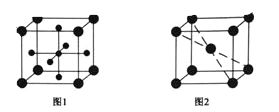
(5)铁晶胞的结构如图 2 所示,如果晶胞边长为 a,铁原子半径为 r,则该晶体中铁原子的空间利用率为______。(只含Π的代数式)
【答案】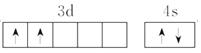 > > N的价电子排布式为2s22p3,O为2s22p4,N为半满结构较稳定,第一电离能大于O 正四面体 sp3 PO43-、ClO4-等 12
> > N的价电子排布式为2s22p3,O为2s22p4,N为半满结构较稳定,第一电离能大于O 正四面体 sp3 PO43-、ClO4-等 12 ![]() ×100%
×100%
【解析】
(1)Ti是22号元素,处于周期表中第四周期IVB族,价电子排布式为3d24s2,结合泡利原理、洪特规则画出价电子排布图;
(2)同周期主族元素随原子序数增大电负性增大;N原子中的2p轨道处于半充满状态,第一电离能高于同周期相邻元素的;
(3)SO42-中S原子孤电子对数=![]() =0,价层电子对数=4=0=4;与SO42-互为等电子体微粒可以用Cl原子替换S原子与1个单位负电荷;
=0,价层电子对数=4=0=4;与SO42-互为等电子体微粒可以用Cl原子替换S原子与1个单位负电荷;
(4)Ti4+位于立方体的顶点,晶胞中Ti4+原子数目为1、体心黑色球数目为1、面心黑色球数目为3,故体心为Ca2+、面心为O2-,与Ti4+紧密相邻的O2-处于面心,每个顶点为8个晶胞共用,每个面心为2个晶胞共用;
(5)处于体对角线上Fe原子相邻,晶胞体对角线长度等于晶胞棱长的![]() 倍,而晶胞体对角线长度=4倍的Fe原子半径,均摊法计算晶胞中Fe原子数目,计算晶胞中原子总体积,晶胞的空间利用率=(原子总体积÷晶胞体积)×100%。
倍,而晶胞体对角线长度=4倍的Fe原子半径,均摊法计算晶胞中Fe原子数目,计算晶胞中原子总体积,晶胞的空间利用率=(原子总体积÷晶胞体积)×100%。
(1)Ti是22号元素,处于周期表中第四周期IVB族,价电子排布式为3d24s2,由泡利原理、洪特规则,价电子排布图为: ;
;
(2)同周期主族元素随原子序数增大电负性增大,故电负性C>B;N原子中的2p轨道处于半充满状态,更稳定,第一电离能高于同周期相邻元素的,故第一电离能:N>O;
(3)SO42-中S原子孤电子对数=![]() =0,价层电子对数=4=0=4,空间构型为正四面体形,S原子采取sp3杂化,与SO42-互为等电子体微粒可以用Cl原子替换S原子与1个单位负电荷,即SO42-的一种等电子体的化学式:PO43-、ClO4-等;
=0,价层电子对数=4=0=4,空间构型为正四面体形,S原子采取sp3杂化,与SO42-互为等电子体微粒可以用Cl原子替换S原子与1个单位负电荷,即SO42-的一种等电子体的化学式:PO43-、ClO4-等;
(4)Ti4+位于立方体的顶点,晶胞中Ti4+原子数目为1、体心黑色球数目为1、面心黑色球数目为3,故体心为Ca2+、面心为O2-,与Ti4+紧密相邻的O2-处于面心,每个顶点为8个晶胞共用,每个面心为2个晶胞共用,即与Ti4+紧密相邻的O2-数目=![]() =12;
=12;
(5)处于体对角线上Fe原子相邻,晶胞体对角线长度等于晶胞棱长的![]() 倍,而晶胞体对角线长度=4倍的Fe原子半径,故4r=
倍,而晶胞体对角线长度=4倍的Fe原子半径,故4r=![]() a,则r=
a,则r=![]() a,晶胞中Fe原子数目=1+8×
a,晶胞中Fe原子数目=1+8×![]() =2,晶胞中原子总体积=2×
=2,晶胞中原子总体积=2×![]() πr3,晶胞的空间利用率=(2×
πr3,晶胞的空间利用率=(2×![]() πr3÷a3)×100%=[(2×
πr3÷a3)×100%=[(2××π×(
![]() a)3÷a3]×100%=
a)3÷a3]×100%=![]() ×100%。
×100%。

 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案【题目】利用催化技术可将汽车尾气中的 NO 和 CO 转变成 CO2 和 N2,化学方程式:2NO(g)+2CO(g)![]() 2CO2(g)+N2(g)。某温度下,在容积不变的密闭容器中通入 NO 和 CO,测得不同时间的 NO 和 CO 的浓度如表:
2CO2(g)+N2(g)。某温度下,在容积不变的密闭容器中通入 NO 和 CO,测得不同时间的 NO 和 CO 的浓度如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)/×10-3mol/L | 1.00 | 0.45 | 0.25 | 0.15 | 0.10 | 0.10 |
c(CO)/×10-3mol/L | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
下列说法中不正确的是( )
A. 2 s 内的平均反应速率 v(N2)=1.875×10-4 mol·L-1·s-1
B. 在该温度下,反应的平衡常数 K=5
C. 若将容积缩小为原来的一半,NO 转化率大于 90%
D. 使用催化剂可以提高单位时间内 CO 和 NO 的处理量