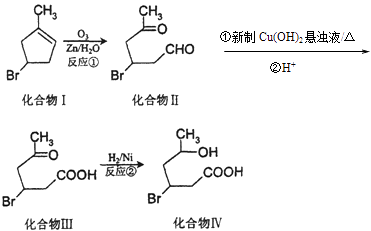
题目内容
【题目】高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂.其生产工艺如下: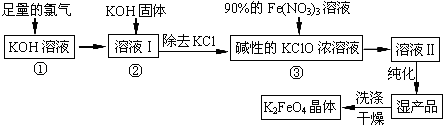
(1)反应①应在温度较低的情况下进行.因在温度较高时KOH 与Cl2 反应生成的是KClO3 . 写出在温度较高时KOH 与Cl2反应的化学方程式 , 该反应的氧化产物是 .
(2)在溶液Ⅰ中加入KOH固体的目的是(填编号).
A.与溶液Ⅰ中过量的Cl2继续反应,生成更多的KClO
B.KOH固体溶解时会放出较多的热量,有利于提高反应速率
C.为下一步反应提供碱性的环境
D.使KClO3转化为 KClO
(3)从溶液Ⅱ中分离出K2FeO4后,还会有副产品KNO3、KCl,则反应③中发生的离子反应方程式为 .
(4)如何判断K2FeO4晶体已经洗涤干净 .
(5)高铁酸钾(K2FeO4)具有极强的氧化性,是一种优良的水处理剂.FeO42﹣在水溶液中的存在形态如图Ⅱ所示.下列说法正确的是(填字母). 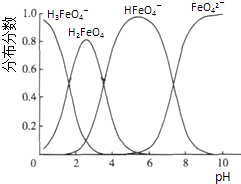
A.不论溶液酸碱性如何变化,铁元素都有4种存在形态
B.向pH=2的这种溶液中加KOH溶液至pH=10,HFeO4﹣的分布分数先增大后减小
C.向pH=8的这种溶液中加KOH溶液,发生反应的离子方程式为:H2FeO4+OH﹣═HFeO4﹣+H2O.
【答案】
(1)6KOH+3Cl2 ![]() KClO3+5KCl+3H2O;KClO3
KClO3+5KCl+3H2O;KClO3
(2)A C
(3)2Fe3++3ClO﹣+10OH﹣=2FeO42﹣+3Cl﹣+5H2O
(4)用试管取少量最后一次的洗涤液,加入硝酸银溶液,无白色沉淀则已被洗净
(5)B
【解析】解:足量氯气通入氢氧化钾溶液中低温反应生成次氯酸钾、氯化钾和水,加入固体氢氧化钾除去氯化钾得到减小次氯酸钾浓溶液,加入硝酸铁浓溶液纯化洗涤干燥得到高铁酸钾,(1)据题目信息、氧化还原反应中化合价发生变化确定产物有:KClO3、KCl、H2O,根据电子得失守恒和质量守恒来配平,可得6KOH+3Cl2 ![]() KClO3+5KCl+3H2O;Cl2既是氧化剂又是还原剂,氯化合价升高,得到 KClO3 , KClO3是还原产物.
KClO3+5KCl+3H2O;Cl2既是氧化剂又是还原剂,氯化合价升高,得到 KClO3 , KClO3是还原产物.
所以答案是:6KOH+3Cl2 ![]() KClO3+5KCl+3H2O; KClO3;(2)A、根据生产工艺流程图,第①步氯气过量,加入KOH固体后会继续反应生成KClO,故A正确;
KClO3+5KCl+3H2O; KClO3;(2)A、根据生产工艺流程图,第①步氯气过量,加入KOH固体后会继续反应生成KClO,故A正确;
B、因温度较高时KOH 与Cl2 反应生成的是KClO3 , 而不是KClO,故B错误;
C、第③步需要碱性条件,所以碱要过量,故C正确;
D、KClO3转化为 KClO,化合价只降不升,故D错误;
故选:A、C;(3)据题目信息和氧化还原反应中化合价发生变化确定找出反应物:Fe3+、ClO﹣ , 生成物:FeO42﹣、Cl﹣ , 根据电子得失守恒和质量守恒来配平,可得2Fe3++3ClO﹣+10OH﹣=2FeO42﹣+3Cl﹣+5H2O.
所以答案是:2Fe3++3ClO﹣+10OH﹣=2FeO42﹣+3Cl﹣+5H2O; (4)只要检验最后一次的洗涤中无Cl﹣ , 即可证明K2FeO4晶体已经洗涤干净,操作方法为用试管取少量最后一次的洗涤液,加入硝酸银溶液,无白色沉淀则已被洗净,
所以答案是:用试管取少量最后一次的洗涤液,加入硝酸银溶液,无白色沉淀则已被洗净;(5)A.不同PH值时,溶液中铁元素的存在形态及种数不相同,比如在PH值等于6时,就只有两种形态,故A错误;
B.根据图片知,改变溶液的pH,当溶液由pH=10降至pH=4的过程中,HFeO4﹣的分布分数先增大后减小,故正确;
C.向pH=8的这种溶液中加KOH溶液,发生反应的离子方程式为:HFeO4﹣+OH﹣=FeO42﹣+H2O,故错误;
所以答案是:B.

 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案【题目】900℃时,向2.0L恒容密闭容器中充入0.40mol乙苯,发生反应: ![]()
![]() +H2(g)△H=akJ.mol﹣1 . 经一段时间后达到平衡.反应过程中测定的部分数据见下表:
+H2(g)△H=akJ.mol﹣1 . 经一段时间后达到平衡.反应过程中测定的部分数据见下表:
时间/min | 0 | 10 | 20 | 30 | 40 |
n(乙苯)/mol | 0.40 | 0.30 | 0.24 | n2 | n3 |
n(苯乙烯)/mol | 0.00 | 0.10 | n1 | 0.20 | 0.20 |
下列说法正确的是( )
A.反应在前20 min的平均速率为v(H2)=0.004molL﹣1min﹣1
B.保持其他条件不变,升高温度,平衡时,c(乙苯)=0.08molL﹣1 , 则a<0
C.保持其他条件不变,向容器中充入不参与反应的水蒸气作为稀释剂,则乙苯的转化率为50.0%
D.相同温度下,起始时向容器中充入0.10mol乙苯、0.10mol苯乙烯和0.30molH2 , 达到平衡前v(正)>v(逆)